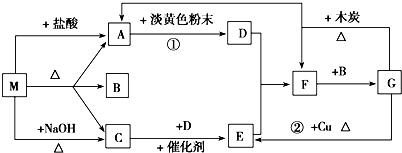
题目内容
Q、W、X、Y、Z是原子序数依次增大的短周期元素,X、Y是金属元素,Q、W、Z是非金属元素.五种元素核电荷数之和为55,对应原子最外层电子数之和为21.W、Z最外层电子数相同,但Z的核电荷数是W的2倍.
(1)Q在周期表中位于第 周期 族.
(2)X、Y各自的最高价氧化物对应的水化物可以发生反应生成盐和水,请写出该反应的离子方程式: .
(3)X单质能在W单质中燃烧可生成化合物R,R的电子式 ,该物质所含有的化学键的类型为 .
(4)Z的氢化物与W的氢化物发生反应生成Z单质和水,写出其化学方程式 .
(1)Q在周期表中位于第
(2)X、Y各自的最高价氧化物对应的水化物可以发生反应生成盐和水,请写出该反应的离子方程式:
(3)X单质能在W单质中燃烧可生成化合物R,R的电子式
(4)Z的氢化物与W的氢化物发生反应生成Z单质和水,写出其化学方程式
考点:位置结构性质的相互关系应用
专题:元素周期律与元素周期表专题
分析:根据题意可知这几种元素分别是:Q是N;W是O;X是Na;Y是Al;Z是S,以此分析.
解答:
解:根据题意可知这几种元素分别是:Q是N;W是O;X是Na;Y是Al;Z是S.
(1)N元素在周期表中位于第二周期第ⅴA 族;故答案为:二;VA;
(2)NaOH与Al(OH)3反应的两种方程式是Al(OH)3+OH-=AlO2-+2H2O,故答案为:Al(OH)3+OH-=AlO2-+2H2O;
(3)Na在氧气中燃烧生成Na2O2,其电子式是 ;在该物质含有的化学键是离子键、非极性共价键,
;在该物质含有的化学键是离子键、非极性共价键,
故答案为: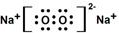 ;离子键、非极性共价键;
;离子键、非极性共价键;
(4)H2S有还原性,而 H2O2有氧化性,二者发生氧化还原反应的化学方程式是H2S+H2O2=S↓+2H2O;故答案为:H2S+H2O2 =S↓+2H2O.
(1)N元素在周期表中位于第二周期第ⅴA 族;故答案为:二;VA;
(2)NaOH与Al(OH)3反应的两种方程式是Al(OH)3+OH-=AlO2-+2H2O,故答案为:Al(OH)3+OH-=AlO2-+2H2O;
(3)Na在氧气中燃烧生成Na2O2,其电子式是
 ;在该物质含有的化学键是离子键、非极性共价键,
;在该物质含有的化学键是离子键、非极性共价键,故答案为:
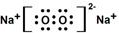 ;离子键、非极性共价键;
;离子键、非极性共价键;(4)H2S有还原性,而 H2O2有氧化性,二者发生氧化还原反应的化学方程式是H2S+H2O2=S↓+2H2O;故答案为:H2S+H2O2 =S↓+2H2O.
点评:本题考查元素的推断、元素在周期表中的位置、结构、性质、电子式、化学方程式、离子方程式的书写,难度不大.

练习册系列答案
 ABC考王全优卷系列答案
ABC考王全优卷系列答案
相关题目
下列说法正确的是( )
| A、氢氧化钠可用食物调整碱性的添加剂 |
| B、棉、麻完全燃烧可以生成CO2和H2O |
| C、脂肪在一定条件下都能发生水解反应 |
| D、汽油、柴油、煤油的主要成分都是碳氢化合物 |
甲醛易溶于水,常温下有刺激性气味,当温度超过20℃时,挥发速度加快.室内装潢和家具挥发出来的甲醛是室内空气的主要污染物.根据甲醛的这些性质,下列做法错误的是( )
| A、人住前,房间内保持一定温度并通风 |
| B、紧密门窗一段时间后入住 |
| C、请环境监测部门检测室内甲醛含量,低于国家标准后才可入住 |
| D、装修尽可能选择在温度较高的季节 |
一定温度下密封容器中发生可逆反应:mA(g)+nB(g)?pC(g),达平衡后,若将气体体积压缩到原来的
.当再达平衡时C的浓度是原来的1.8倍,则下列叙述正确的是( )
| 1 |
| 2 |
| A、C气体的体积分数增大 |
| B、m+n>p |
| C、气体A的转化率升高 |
| D、平衡向逆反应方向移动 |
下列说法正确的是( )
| A、醋酸溶液中滴入石蕊呈红色,证明醋酸是弱电解质 |
| B、液态HCl不导电,证明HCl是共价化合物 |
| C、饱和石灰水中加入少量CaO,恢复至室温,溶液的pH增大 |
| D、向Na2CO3溶液中加入少量NaOH固体,抑制CO32-水解,溶液pH减小 |
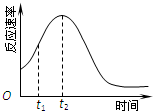 教材中用酸性KMnO4和H2C2O4(草酸)反应研究影响反应速率的因素,离子方程式为:2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O.一实验小组欲通过测定单位时间内生成CO2的速率,探究某种影响化学反应速率的因素,设计实验方案如下(KMnO4溶液已酸化):
教材中用酸性KMnO4和H2C2O4(草酸)反应研究影响反应速率的因素,离子方程式为:2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O.一实验小组欲通过测定单位时间内生成CO2的速率,探究某种影响化学反应速率的因素,设计实验方案如下(KMnO4溶液已酸化):