题目内容
 在硝酸铵和硫酸铵的固体混合物中加入50mL NaOH溶液,充分加热反应,混合的质量与产生的气体的体积如图所示.
在硝酸铵和硫酸铵的固体混合物中加入50mL NaOH溶液,充分加热反应,混合的质量与产生的气体的体积如图所示.(1)求该NaOH溶液的pH值
(2)固体混合物中硝酸铵和硫酸铵的物质的量之比
(3)该固体混合物中氮元素的质量分数.
考点:有关混合物反应的计算
专题:计算题
分析:(1)氢氧化钠与NH4NO3和(NH4)2SO4的混合物生成氨气,发生反应NH4++OH-
NH3↑+2H2O,由图象可知,加入固体3.44g时生成氨气体积增大为1.12L,根据n=
氨气的物质的量,结合方程式计算氢氧根的物质的量,再根据c=
计算氢氧化钠的物质的量浓度及溶液的pH;
(2)根据图象可知,3.44g硝酸铵和硫酸铵的固体混合物分别与氢氧化钠溶液反应生成标况下1.12L氨气,设出混合物中硝酸铵、硫酸铵的物质的量,然后列式计算出二者物质的量及物质的量之比;
(3)结构(2)计算结果计算出3.44g氮原子的物质的量、质量,再计算出混合物中含有氮元素的质量分数.
| ||
| V |
| Vm |
| n |
| V |
(2)根据图象可知,3.44g硝酸铵和硫酸铵的固体混合物分别与氢氧化钠溶液反应生成标况下1.12L氨气,设出混合物中硝酸铵、硫酸铵的物质的量,然后列式计算出二者物质的量及物质的量之比;
(3)结构(2)计算结果计算出3.44g氮原子的物质的量、质量,再计算出混合物中含有氮元素的质量分数.
解答:
解:(1)根据反应NH4++OH-
NH3↑+2H2O可知,n(NaOH)=n(NH3)=
=0.05mol,则50mL该氢氧化钠溶液中含有氢氧化钠的物质的量为:n(NaOH)=n(NH3)=0.05mol,则氢氧化钠溶液的浓度为:c(NaOH)=
=1mol/L,1mol/L的氢氧化钠溶液中,氢离子浓度为:
mol/L=1×10-14mol/L,则该氢氧化钠溶液的pH=14,
答:该氢氧化钠溶液的pH为14;
(2)根据图象可知,3.44g硝酸铵和硫酸铵的固体混合物分别与氢氧化钠溶液反应生成标况下1.12L氨气,
设3.44g混合物中含有xmol硝酸铵、ymol硫酸铵,
则:①80x+132y=3.44g,②x+2y=
=0.05mol,
根据①②联立解得:y=0.02、x=0.01,
则固体混合物中硝酸铵和硫酸铵的物质的量之比为:0.01mol:0.02mol=1:2,
答:固体混合物中硝酸铵和硫酸铵的物质的量之比为1:2;
(3)根据(2)可知,3.44g混合物中含有0.01molNH4NO3、0.02mol(NH4)2SO4,
则3.44g混合物中含有N原子的物质的量为:0.01mol×(1+1)+0.02mol×2=0.06mol,
则混合物中氮元素的质量分数为:
≈0.244,
答:该固体混合物中氮元素的质量分数为0.244.
| ||
| 1.12L |
| 22.4L/mol |
| 0.05mol |
| 0.05L |
| 1×10-14 |
| 1 |
答:该氢氧化钠溶液的pH为14;
(2)根据图象可知,3.44g硝酸铵和硫酸铵的固体混合物分别与氢氧化钠溶液反应生成标况下1.12L氨气,
设3.44g混合物中含有xmol硝酸铵、ymol硫酸铵,
则:①80x+132y=3.44g,②x+2y=
| 1.12L |
| 22.4L/mol |
根据①②联立解得:y=0.02、x=0.01,
则固体混合物中硝酸铵和硫酸铵的物质的量之比为:0.01mol:0.02mol=1:2,
答:固体混合物中硝酸铵和硫酸铵的物质的量之比为1:2;
(3)根据(2)可知,3.44g混合物中含有0.01molNH4NO3、0.02mol(NH4)2SO4,
则3.44g混合物中含有N原子的物质的量为:0.01mol×(1+1)+0.02mol×2=0.06mol,
则混合物中氮元素的质量分数为:
| 14g/mol×0.06mol |
| 3.44g |
答:该固体混合物中氮元素的质量分数为0.244.
点评:本题以图象形式考查了混合物的有关计算,题目难度中等,注意明确发生反应的本质,利用离子方程式进行解答,综合考查学生分析解决问题的能力.

练习册系列答案
 优翼小帮手同步口算系列答案
优翼小帮手同步口算系列答案
相关题目
实验是解决化学问题的基本途径,下列有关实验的叙述不正确的是( )
| A、240 mL 0.2 mol?L-1的NaCl溶液配制:需要使用天平、250 mL容量瓶等仪器 |
| B、向FeCl3稀溶液中滴加NaOH溶液,并加热煮沸,可制备Fe(OH)3胶体 |
| C、不慎将NaOH溶液溅到皮肤上,应立即用较多的水冲洗 |
| D、用苯萃取碘水中的碘时,萃取后的油层不能从分液漏斗下端放出 |
用标准盐酸滴定未知浓度的NaOH溶液,下列各操作中正确的是( )
| A、用蒸馏水冼净滴定管后,即装入标准盐酸进行滴定 |
| B、用蒸馏水冼净锥形瓶后,再用NaOH液润洗,而后装入一定体积的NaOH溶液 |
| C、用碱式滴定管取10.00mLNaOH溶液放入洁净的锥形瓶中,再加入适量蒸馏水后进行滴定 |
| D、改用量筒量取10.0mLNaOH溶液,放入锥形瓶后进行滴定 |
四种短周期元素在周期表中位置如图,只有M为金属元素.说法不正确的是( )
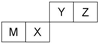

| A、X 的最简单气态氢化物的热稳定性比Z的小 |
| B、Z位于元索周期表中第2周期、第ⅥA族 |
| C、原子半径Z<M |
| D、Y的最高价氧化物对应水化物的酸性比X 的弱 |
硫酸的浓度为0.005mol/L,则溶液的PH值为( )
| A、2 | B、4 | C、10 | D、12 |
