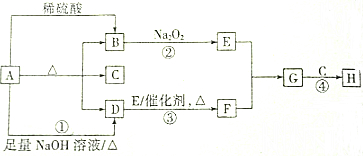
题目内容
2.有一固体混合物,可能由KCl、Na2CO3、Na2SO4、CaCl2、Cu(NO3)2中的一种或几种组成,为了检验所含的物质,做了以下实验:
①取少许固体溶于水,得到无色透明溶液;
②往此溶液中滴加氯化钡溶液,有白色沉淀生成;
③过滤,往沉淀中加入足量的稀硝酸,发现沉淀没有全部溶解且有无色无味的气体生成.
(1)试判断:固体混合物中肯定含有Na2CO3、Na2SO4,一定没有Cu(NO3)2、CaCl2,可能含有KCl.
(2)对可能含有的物质,如何进行实验以进一步检验:做焰色反应,若透过蓝色钴玻璃有紫色火焰,则含KCl,反之,则没有.
分析 ①将固体混合物溶于水中,搅拌后得无色透明溶液判断一定无Cu(NO3)2;CaCl2和Na2CO3、CaCl2和Na2SO4二者不能同时含有;
②往此溶液中滴加硝酸钡,有白色沉淀产生;说明可能含有Na2SO4、Na2CO3中的至少一种,判断一定不能含有CaCl2;
③过滤,将沉淀物置于稀硝酸中,发现沉淀部分溶解,说明生成的沉淀是碳酸钡和硫酸钡沉淀,证明一定含有Na2CO3、Na2SO4;
据此回答判断即可.
解答 解:①将固体混合物溶于水中,搅拌后得无色透明溶液判断一定无Cu(NO3)2;CaCl2和Na2CO3、CaCl2和Na2SO4二者不能同时含有;
②往此溶液中滴加硝酸钡,有白色沉淀产生;说明可能含有Na2SO4、Na2CO3中的至少一种,判断一定不能含有CaCl2;
③过滤,将沉淀物置于稀硝酸中,发现沉淀部分溶解,说明生成的沉淀是碳酸钡和硫酸钡沉淀,证明一定含有Na2CO3、Na2SO4;
(1)肯定含有Na2CO3、Na2SO4,一定没有Cu(NO3)2、CaCl2,可能含有KCl,故答案为:Na2CO3、Na2SO4;Cu(NO3)2、CaCl2;KCl;
(2)可以加入硝酸银检验氯化钾的存在,故答案为:做焰色反应,若透过蓝色钴玻璃有紫色火焰,则含KCl;反之,则没有.
点评 本题考查了物质检验的方法和反应现象的分析应用,主要考查物质的特征性质应用,注意利用离子共存的分析进行判断.

练习册系列答案
相关题目
12. 常温下,向盛有1L0.1mol•L-1NaHSO4溶液的烧杯中不断滴加0.05mol/L的Ba(OH)2溶液,溶液中产生沉淀物质的量n(mol)与溶液pH的变化情况如图所示,下列说法不正确的是( )
常温下,向盛有1L0.1mol•L-1NaHSO4溶液的烧杯中不断滴加0.05mol/L的Ba(OH)2溶液,溶液中产生沉淀物质的量n(mol)与溶液pH的变化情况如图所示,下列说法不正确的是( )
 常温下,向盛有1L0.1mol•L-1NaHSO4溶液的烧杯中不断滴加0.05mol/L的Ba(OH)2溶液,溶液中产生沉淀物质的量n(mol)与溶液pH的变化情况如图所示,下列说法不正确的是( )
常温下,向盛有1L0.1mol•L-1NaHSO4溶液的烧杯中不断滴加0.05mol/L的Ba(OH)2溶液,溶液中产生沉淀物质的量n(mol)与溶液pH的变化情况如图所示,下列说法不正确的是( )| A. | A点时pH=1 | |
| B. | 恰好完全沉淀时Ba(OH)2溶液的体积为2L | |
| C. | B点时,溶液中的离子浓度关系为c(Na+)>c(SO42-)>c(H+)=c(OH-) | |
| D. | C点时pH=14 |
7.某硫酸和硝酸的混合溶液20mL,其中含有硫酸的浓度为2mol•L-1,含有硝酸的浓度为1mol•L-1,现向其中加入0.96g 铜粉,充分反应后(假设只生成NO气体),最多可收集到标准状况下的气体的体积为( )
| A. | 224 mL | B. | 168 mL | C. | 112 mL | D. | 448 mL |
14.物质的量浓度相等的三种溶液:①H2C03②NaOH③Na2C03溶液,下列说法不正确的是( )
| A. | 水电离出的c(OH):③>①>② | |
| B. | 溶液的pH:②>③>① | |
| C. | ①和②等体积混合后的溶液:c(Na+)═c(H2C03)+c(HC03)+c(C032-) | |
| D. | ①和③等体积混合后的溶液:c(Na+)>c(HC03-)>c(C032-)>c(OH-)>c(H+) |
11.一定条件下,下列反应中水蒸气含量随反应时间的变化趋势符合如图的是( )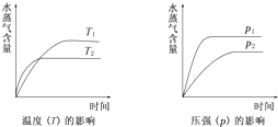

| A. | CH3CH2OH?CH2=CH2(g)+H2O(g);△H>0 | |
| B. | CO2(g)+H2(g)?CO(g)+H2O(g);△H>0 | |
| C. | CO2(g)+2NH3( g)?CO(NH2)2(s)+H2O(g);△H<0 | |
| D. | 2C6H5CH2CH3(g)+O2(g)?2C6H-5CH=CH2(g)+2H2O(g);△H<0 |
12.下列各组中的关系互为同系物的是( )
| A. | C2H6和C3H8 | B. | CH3-CH2-CH2-CH3和 | ||
| C. | 1H和2H | D. | O2和O3 |