题目内容
16.青蒿素的熔点为156~157℃,密度约为1.3g•cm-3.青蒿素可溶于乙醚.几乎不溶于水,下列实验方法能达到实验目的是( )| 选项 | 实验目的 | 实验方法 |
| A | 分离水和青蒿素 | 分液 |
| B | 分离乙醇和水 | 灼烧 |
| C | 分离碳酸钠和碳酸氢钠 | 过滤 |
| D | 除去碳酸钙中含有的少量氯化钙 | 萃取 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.青蒿素不溶于水,易溶于有机溶剂,可萃取分液;
B.乙醇和水的沸点不同;
C.碳酸氢钠不稳定,加热易分解;
D.碳酸钙不溶于水.
解答 解:A.青蒿素不溶于水,易溶于有机溶剂,可萃取分液,可分离,故A正确;
B.乙醇和水的沸点不同,应用蒸馏的方法分离,故B错误;
C.碳酸氢钠不稳定,加热易分解,可用加热的方法分离,故C错误;
D.碳酸钙不溶于水,可用过滤的方法分离,故D错误.
故选A.
点评 本题综合考查物质的分离、提纯,为高频考点,侧重考查学生的分析能力和实验能力,注意把握物质的性质的异同,注意除杂时不能引入新杂质,难度不大.

练习册系列答案
相关题目
7.有X、Y、Z、M、G五种原子序数依次增大的短周期元素,其性质或原子结构如表所示.下列有关说法正确的是
( )
( )
| 编号 | 元素性质或原子结构 |
| X | X的某一种原子没有中子 |
| Y | 最高正价与最低负价的代数和为0 |
| Z | 最外层电子数是周期数的3倍 |
| M | 含M元素的物质,其焰色反应为黄色 |
| G | G的简单离子半径在同周期中最小 |
| A. | X是组成有机物的必需元素 | |
| B. | Y、Z所形成的氢化物分子均含有10个电子 | |
| C. | Z的简单离子半径大于G的简单离子半径 | |
| D. | G的氧化物不溶于M的最高价氧化物所对应的水化物的水溶液 |
4.下列说不正确是( )
| A. | 分子间作用力越弱,分子晶体的熔点越低 | |
| B. | 氯化铵受热分解,断裂离子键和共价键 | |
| C. | 金刚石、C60都不存在独立的小分子 | |
| D. | 断裂化学键,需要吸收能量 |
8.化学科学需要借助化学专用语言来描述,下列有关化学用语正确的是( )
| A. | CO2的电子式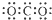 | B. | 质量数为37的氯原子${\;}_{37}^{17}$Cl | ||
| C. | 乙烯的结构简式C2H4 | D. | Cl-的结构示意图: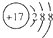 |
6.质量为ag的铜片在空气中灼烧变黑,趁热放入下列物质中后,质量大于ag的是( )
| A. | 盐酸 | B. | 无水乙醇 | C. | 澄清石灰水 | D. | 硫酸 |