题目内容
下列热化学方程式正确的是(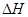 的绝对值均正确)
的绝对值均正确)
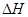 的绝对值均正确)
的绝对值均正确)| A.C2H5OH(l)+3O2(g)==2CO2(g)+3H2O(g);△H=—1367.0 kJ/mol(燃烧热) |
| B.NaOH(aq)+HCl(aq)==NaCl(aq)+H2O(l);△H=+57.3kJ/mol(中和热) |
| C.S(s)+O2(g)===SO2(g);△H=—269.8kJ/mol(反应热) |
| D.2NO2==O2+2NO;△H=+116.2kJ/mol(反应热) |
C
试题分析:A中,燃烧热的单位为kJ/g,B中中和热中△H的符号应该为符号,C正确,D中,缺少各物质的状态。
点评:本题考查了热化学方程式的书写,属于高考考查的重点,本题要注意△H的单位和符号,以及热化学方程式要标明各物质的状态。

练习册系列答案
 天天向上口算本系列答案
天天向上口算本系列答案
相关题目
 CH3OH(g)
CH3OH(g)



 2NH3(g)ΔH=-92kJ/mol(表示当生成2 mol NH3时放出92.2KJ的热)。有关键能:N≡N:945.6kJ/mol ;N-H:391.0kJ/mol,则H—H键能为 KJ/mol
2NH3(g)ΔH=-92kJ/mol(表示当生成2 mol NH3时放出92.2KJ的热)。有关键能:N≡N:945.6kJ/mol ;N-H:391.0kJ/mol,则H—H键能为 KJ/mol 4CO2(g) + 2H2O(l) + 2600 kJ
4CO2(g) + 2H2O(l) + 2600 kJ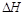 =______________。
=______________。