题目内容
I.工业上可用CO生产燃料甲醇。一定条件下发生反应:CO(g)+2H2(g) CH3OH(g)
CH3OH(g)

(1)“图1”表示反应中能量的变化,曲线 (填“a或b”)表示使用了催化剂;该反应的热化学方程式为 。
(2)若容器容积不变,下列措施可增大CO平衡转化率的是_____。
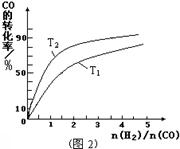
(3)其他条件不变,请在“图2”中画出温度为T2(且T2<T1)时,CO的平衡转化率与H2和CO的起始组成比[n(H2)/n(CO)]的关系曲线。

II.向BaSO4沉淀中加入饱和碳酸钠溶液,充分搅拌,弃去上层清液,如此处理多次,可使BaSO4全部转化为BaCO3,发生的反应可表示为:BaSO4(s)+CO32-(aq) BaCO3(s)+SO42-(aq)。
BaCO3(s)+SO42-(aq)。
(4)现有0.20 mol BaSO4,加入1.0L 2.0mol/L的饱和Na2CO3溶液处理,假设起始的c(SO42-)≈0,平衡时,K=4.0×10-2,求达到平衡时发生转化的BaSO4的物质的量。(写出计算过程,计算结果保留2位有效数字)
 CH3OH(g)
CH3OH(g)
(1)“图1”表示反应中能量的变化,曲线 (填“a或b”)表示使用了催化剂;该反应的热化学方程式为 。
(2)若容器容积不变,下列措施可增大CO平衡转化率的是_____。
| A.升高温度 |
| B.将CH3OH(g)从体系中分离 |
| C.充入He,使体系总压强增大 |
| D.再充入1 mol CO和2 mol H2 |

II.向BaSO4沉淀中加入饱和碳酸钠溶液,充分搅拌,弃去上层清液,如此处理多次,可使BaSO4全部转化为BaCO3,发生的反应可表示为:BaSO4(s)+CO32-(aq)
 BaCO3(s)+SO42-(aq)。
BaCO3(s)+SO42-(aq)。(4)现有0.20 mol BaSO4,加入1.0L 2.0mol/L的饱和Na2CO3溶液处理,假设起始的c(SO42-)≈0,平衡时,K=4.0×10-2,求达到平衡时发生转化的BaSO4的物质的量。(写出计算过程,计算结果保留2位有效数字)
(16分)
(1)b(1分)
CO(g)+2H2(g) CH3OH(g) △H=-91kJ/mol (3分,方程式含状态符号正确给1分;反应热2分,其中单位写错扣1分,但结果或符号写错不给分,可逆符号也可以写成等号)
CH3OH(g) △H=-91kJ/mol (3分,方程式含状态符号正确给1分;反应热2分,其中单位写错扣1分,但结果或符号写错不给分,可逆符号也可以写成等号)
(2)BD(4分,答对1个给2分,但错选不给分)
(3)如图(2分,作图1分,标注1分)
(4)解:设发生转化的BaSO4的物质的量为x mol ,则平衡时c(SO42-)为x mol/L
BaSO4 + CO32- BaCO3 + SO42-
BaCO3 + SO42-
起始浓度/mol?L-1 2.0 0
变化浓度/mol?L-1 x x
平衡浓度/mol?L-1 2.0-x x
K=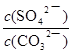 =
=  = 4.0×10-2(2分,单位无写不扣分)
= 4.0×10-2(2分,单位无写不扣分)
解得:x = 7.7×10-2 (或0.077) 即发生转化的BaSO4的物质的量为7.7×10-2 mol。(2分,单位及有效数字错误各扣1分)
(1)b(1分)
CO(g)+2H2(g)
 CH3OH(g) △H=-91kJ/mol (3分,方程式含状态符号正确给1分;反应热2分,其中单位写错扣1分,但结果或符号写错不给分,可逆符号也可以写成等号)
CH3OH(g) △H=-91kJ/mol (3分,方程式含状态符号正确给1分;反应热2分,其中单位写错扣1分,但结果或符号写错不给分,可逆符号也可以写成等号)(2)BD(4分,答对1个给2分,但错选不给分)
(3)如图(2分,作图1分,标注1分)

(4)解:设发生转化的BaSO4的物质的量为x mol ,则平衡时c(SO42-)为x mol/L
BaSO4 + CO32-
 BaCO3 + SO42-
BaCO3 + SO42-起始浓度/mol?L-1 2.0 0
变化浓度/mol?L-1 x x
平衡浓度/mol?L-1 2.0-x x
K=
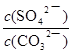 =
=  = 4.0×10-2(2分,单位无写不扣分)
= 4.0×10-2(2分,单位无写不扣分)解得:x = 7.7×10-2 (或0.077) 即发生转化的BaSO4的物质的量为7.7×10-2 mol。(2分,单位及有效数字错误各扣1分)
试题分析:(1)读图,反应物能量高于生成物能量,该反应的焓变为-91kJ/mol,曲线b有2个峰,a只有1个峰,且前者的2个峰均低于后者的1个峰,说明b使用了催化剂,将1个化学反应变为2个先后或连续发生的化学反应,且降低了反应的活化能,但是对总反应的焓变无影响,所以该反应的热化学方程式为CO(g)+2H2(g)
 CH3OH(g) △H=-91kJ/mol;(2)由于正反应是放热反应,其它条件相同时,升高温度平衡向逆反应方向移动,则CO平衡转化率减小,故A错误;甲醇是生成物,从平衡体系移走生成物,减小生成物浓度,平衡向正反应方向移动,反应物平衡转化率增大,故B正确;由于容器容积不变,虽然充入氦气增大压强,但是平衡体系各组分的物质的量、物质的量浓度均不变,所以平衡不能移动,反应物平衡转化率保持不变,故C错误;再充入1molCO和2molH2,就是增大压强,由于正反应是气体体积减小的反应,增大压强平衡向正反应方向移动,反应物的平衡转化率增大,故D正确;(3)读图,横坐标表示氢气和一氧化碳的起始组成比,纵坐标表示CO的平衡转化率;当氢气和一氧化碳的起始组成比为0时,CO的平衡转化率为0;当氢气和一氧化碳的起始组成比相同且不为零时,由于正反应是放热反应,降低温度平衡向正反应方向移动,CO的平衡转化率增大;当氢气和一氧化碳的起始组成比增大时,增大氢气的浓度,平衡向正反应方向移动,CO的平衡转化率增大;根据上述要点作图,可以画出温度为T2时,CO的平衡转化率随氢气和一氧化碳的起始组成比变化的示意图;(4)设硫酸钡溶解的物质的量为xmol,由于BaSO4 + CO32-
CH3OH(g) △H=-91kJ/mol;(2)由于正反应是放热反应,其它条件相同时,升高温度平衡向逆反应方向移动,则CO平衡转化率减小,故A错误;甲醇是生成物,从平衡体系移走生成物,减小生成物浓度,平衡向正反应方向移动,反应物平衡转化率增大,故B正确;由于容器容积不变,虽然充入氦气增大压强,但是平衡体系各组分的物质的量、物质的量浓度均不变,所以平衡不能移动,反应物平衡转化率保持不变,故C错误;再充入1molCO和2molH2,就是增大压强,由于正反应是气体体积减小的反应,增大压强平衡向正反应方向移动,反应物的平衡转化率增大,故D正确;(3)读图,横坐标表示氢气和一氧化碳的起始组成比,纵坐标表示CO的平衡转化率;当氢气和一氧化碳的起始组成比为0时,CO的平衡转化率为0;当氢气和一氧化碳的起始组成比相同且不为零时,由于正反应是放热反应,降低温度平衡向正反应方向移动,CO的平衡转化率增大;当氢气和一氧化碳的起始组成比增大时,增大氢气的浓度,平衡向正反应方向移动,CO的平衡转化率增大;根据上述要点作图,可以画出温度为T2时,CO的平衡转化率随氢气和一氧化碳的起始组成比变化的示意图;(4)设硫酸钡溶解的物质的量为xmol,由于BaSO4 + CO32-  BaCO3 + SO42-中各物质的系数之比等于物质的量之比,则碳酸根离子、硫酸根离子的变化物质的量均为xmol,由于饱和碳酸钠溶液的体积为1L,由于c=n/V,则碳酸根离子、硫酸根离子的变化物质的量浓度均为xmol/L,由此推断该可逆反应中有关组分的(起始、变化、平衡)浓度,则:
BaCO3 + SO42-中各物质的系数之比等于物质的量之比,则碳酸根离子、硫酸根离子的变化物质的量均为xmol,由于饱和碳酸钠溶液的体积为1L,由于c=n/V,则碳酸根离子、硫酸根离子的变化物质的量浓度均为xmol/L,由此推断该可逆反应中有关组分的(起始、变化、平衡)浓度,则:BaSO4 + CO32-
 BaCO3 + SO42-
BaCO3 + SO42-起始浓度/mol?L-1 2.0 0
变化浓度/mol?L-1 x x
平衡浓度/mol?L-1 2.0-x x
K=
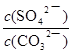 =
=  = 4.0×10-2
= 4.0×10-2解得:x = 7.7×10-2 (或0.077)
即发生转化的BaSO4的物质的量为7.7×10-2 mol。

练习册系列答案
 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案
相关题目
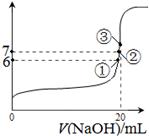
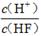 D.
D.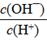
 X(g);△H=-dJ·mol-1(d>0,X为A、B、C三种元素组成的一种化合物)。初始投料与各容器达到平衡时的有关数据如下:
X(g);△H=-dJ·mol-1(d>0,X为A、B、C三种元素组成的一种化合物)。初始投料与各容器达到平衡时的有关数据如下:
 2CO(g)+2H2(g)。平衡体系中各组分体积分数如下表:
2CO(g)+2H2(g)。平衡体系中各组分体积分数如下表:
 2NH3(g) △H<0。某实验将3.0 mol N2(g)和4. 0 mol H2(g)充入容积为10L的密闭容器中,在温度T1下反应。测得H2的物质的量随反应时间的变化如下图所示。
2NH3(g) △H<0。某实验将3.0 mol N2(g)和4. 0 mol H2(g)充入容积为10L的密闭容器中,在温度T1下反应。测得H2的物质的量随反应时间的变化如下图所示。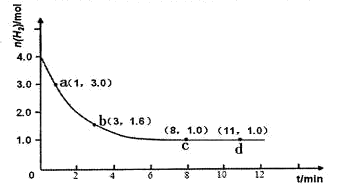

 Fe3O4(s)+4H2(g) △H=akJ/mol (I)
Fe3O4(s)+4H2(g) △H=akJ/mol (I)
 的绝对值均正确)
的绝对值均正确)