题目内容
氨气是一种重要的物质,可用于制取化肥和硝酸等。
(1)500°C、50Mpa时,在容积为VL的密闭容器中加入n mol N2、3n mol H2,经过t min后反应达到平衡后N2的转化率为a。则容器内气体的压强反应前与平衡时的比值
为 ; t min内用NH3表示的速率是
(2)工业合成氨的热化学方程式为:N2(g)+3H2(g) 2NH3(g)ΔH=-92kJ/mol(表示当生成2 mol NH3时放出92.2KJ的热)。有关键能:N≡N:945.6kJ/mol ;N-H:391.0kJ/mol,则H—H键能为 KJ/mol
2NH3(g)ΔH=-92kJ/mol(表示当生成2 mol NH3时放出92.2KJ的热)。有关键能:N≡N:945.6kJ/mol ;N-H:391.0kJ/mol,则H—H键能为 KJ/mol
(1)500°C、50Mpa时,在容积为VL的密闭容器中加入n mol N2、3n mol H2,经过t min后反应达到平衡后N2的转化率为a。则容器内气体的压强反应前与平衡时的比值
为 ; t min内用NH3表示的速率是
(2)工业合成氨的热化学方程式为:N2(g)+3H2(g)
 2NH3(g)ΔH=-92kJ/mol(表示当生成2 mol NH3时放出92.2KJ的热)。有关键能:N≡N:945.6kJ/mol ;N-H:391.0kJ/mol,则H—H键能为 KJ/mol
2NH3(g)ΔH=-92kJ/mol(表示当生成2 mol NH3时放出92.2KJ的热)。有关键能:N≡N:945.6kJ/mol ;N-H:391.0kJ/mol,则H—H键能为 KJ/mol(6分)(1) (2分);2an / Vtmol·L-1·min-1(2分)
(2分);2an / Vtmol·L-1·min-1(2分)
(2)436.1kJ/mol (2分)
 (2分);2an / Vtmol·L-1·min-1(2分)
(2分);2an / Vtmol·L-1·min-1(2分)(2)436.1kJ/mol (2分)
试题分析:(1) N2(g)+3H2(g)
 2NH3(g)
2NH3(g)起始量(mol) n 3n 0
转化量(mol) na 3na 2na
平衡量(mol) n-na 3n-3na 2na
所以容器内气体的压强反应前与平衡时的比值为

t min内用NH3表示的速率是
 =2an / Vtmol·L-1·min-1
=2an / Vtmol·L-1·min-1(2)反应热就是断键吸收的能量和形成新化学键时所放出的能量的差值,则945.6kJ/mol+3×x-2×3×391.0kJ/mol=-92.2 KJ/mol,解得x=436.1kJ/mol。
点评:该题是基础性试题的考查,难度不大。主要是考查学生对教材基础知识的熟悉了解程度,旨在巩固学生的基础,提高学生的能力。有利于培养学生的逻辑推理能力和规范的答题能力。该题的关键是明确反应速率的会议以及反应热的计算依据,然后结合题意灵活运用即可。

练习册系列答案
相关题目
 X(g);△H=-dJ·mol-1(d>0,X为A、B、C三种元素组成的一种化合物)。初始投料与各容器达到平衡时的有关数据如下:
X(g);△H=-dJ·mol-1(d>0,X为A、B、C三种元素组成的一种化合物)。初始投料与各容器达到平衡时的有关数据如下:
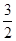 O2(g)=SO2(g)+H2O(g) △H1
O2(g)=SO2(g)+H2O(g) △H1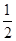 O2(g)=S(g)+H2O(g) △H3
O2(g)=S(g)+H2O(g) △H3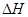 的绝对值均正确)
的绝对值均正确)
 ,
, 
