题目内容
下列关于价电子构型为3s23p4的粒子描述正确的是( )
| A、它的原子核外有三种形状不同的电子云 |
| B、它的原子核外电子共有16种不同的运动状态 |
| C、它可与H2反应生成的化合物为非极性分子 |
D、核外电子轨道表示式为: |
考点:原子核外电子排布
专题:原子组成与结构专题
分析:A.电子云的形状种数由该原子能级种类确定;
B.原子核外电子运动状态和该原子的核外电子数相等;
C.硫与氢气反应生成硫化氢为极性分子;
D.3p能级上电子排布图违反洪特规则;
B.原子核外电子运动状态和该原子的核外电子数相等;
C.硫与氢气反应生成硫化氢为极性分子;
D.3p能级上电子排布图违反洪特规则;
解答:
解:A.价电子构型为3s23p4的元素是16号元素S,具有s和p两种能级,因此该原子的电子云形状有两种,故A错误;
B.S原子具有16个核外电子,处于不同能层、能级上的电子具有的能量不同,同一能级上的电子自旋方向相反,故有16种不同的运动状态,故B正确;
C.硫和氢气化合生成的硫化氢,分子构型V型,为极性分子,故C错误;
D.电子排布在同一能级的不同轨道时,总是优先单独占据一个轨道,且自旋方向相同,所以3p能级上电子排布图违反洪特规则,故D错误;
故选:B.
B.S原子具有16个核外电子,处于不同能层、能级上的电子具有的能量不同,同一能级上的电子自旋方向相反,故有16种不同的运动状态,故B正确;
C.硫和氢气化合生成的硫化氢,分子构型V型,为极性分子,故C错误;
D.电子排布在同一能级的不同轨道时,总是优先单独占据一个轨道,且自旋方向相同,所以3p能级上电子排布图违反洪特规则,故D错误;
故选:B.
点评:本题考查原子核外电子排布,明确构造原理、洪特规则等知识点是解本题关键,题目难度不大.

练习册系列答案
 阶梯计算系列答案
阶梯计算系列答案
相关题目
下列基态原子的电子排布式中,其未成对电子数最多的是( )
| A、1s22s22p63s23p63d64s2 |
| B、1s22s22p63s23p64s1 |
| C、1s22s22p63s23p63d54s1 |
| D、1s22s22p63s23p63d104s1 |
下列递变规律不正确的是( )
| A、钠、镁、铝单质还原性依次减弱 |
| B、碘、溴、氯单质氧化性依次增强 |
| C、C、N、O原子半径依次减小 |
| D、N、O、F最高正价依次升高 |
下列各反应中属于加成反应的是( )
①CH2═CH2+H-OH
CH3CH2OH
②H2+Cl2
2HCl
③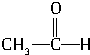 +H2
+H2
CH3-CH2-OH
④CH3-CH3+2Cl2
CH2Cl-CH2Cl+2HCl.
①CH2═CH2+H-OH
| 一定条件 |
②H2+Cl2
| ||
③
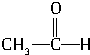 +H2
+H2| 催化剂 |
④CH3-CH3+2Cl2
| 光照 |
| A、①③ | B、②③ | C、①② | D、②④ |
下列各组物质全部是弱电解质的是( )
| A、H2SiO3 H2S CO2 |
| B、MgSO4 CH3COOH CH3CH2OH |
| C、H2SO3 BaSO4 CH4 |
| D、H2O NH3?H2O H3PO4 |
将19.2g铜粉与一定量的浓硝酸反应生成硝酸盐,水及气体,当铜粉完全作用时收集到气体11.2L NO,NO2混合气(标准状况,),则所消耗硝酸的物质的量是( )
| A、1.2mol |
| B、1.1mol |
| C、0.9mol |
| D、0.8mol |
下列各组离子中,在pH=1的溶液中能大量共存且为无色透明溶液的是( )
| A、K+、HCO3-、Na+、SO42- |
| B、NH4+、SO42-、Ba2+、Cl- |
| C、Na+、MnO4-、NO3-、K+ |
| D、Na+、SO42-、Mg2+、Cl- |
下列表达方式错误的是( )
A、甲烷的电子式 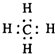 | ||
B、氟化钠的电子式 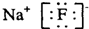 | ||
| C、硫离子的核外电子排布式 1s22s22p63s23p4 | ||
D、碳-12原子
|