题目内容
A、B、C、D、E、F、G为七种由短周期元素构成的微粒.它们都有10个电子.其结构特点如下表:
其中,B的离子半径大于E的离子半径;D是极性键构成的4原子极性分子;C常用作F的检出(加热).请填写以下空白:
(1)A微粒的结构示意图是 .
(2)比较BC和EC2的碱性强弱BC EC2(填写>、<、=).
(3)F与G反应的离子方程式 .
| 微粒代号 | A | B | C | D | E | F | G |
| 原子核数 | 单核 | 单核 | 双核 | 多核 | 单核 | 多核 | 多核 |
| 电荷数(单位电荷) | 0 | 1+ | 1- | 0 | 2+ | 1+ | 0 |
(1)A微粒的结构示意图是
(2)比较BC和EC2的碱性强弱BC
(3)F与G反应的离子方程式
考点:位置结构性质的相互关系应用
专题:元素周期律与元素周期表专题
分析:A是单核且含有10电子的微粒,则A是Ne;B是单核且带1个单位正电荷的离子,电子数为10,则B是Na+;
C是双核10电子微粒,且带一个单位负电荷,则C是OH-;
D是多核10电子分子,D是极性键构成的4原子极性分子,则D是NH3;
E是单核带2个单位正电荷的10电子阳离子,则E是Mg2+;F是多核带1个单位正电荷的10电子阳离子,且C常用作F的检出(加热),则F是NH4+;G为多核10电子分子,G可能为H2O或CH4,据此答题.
C是双核10电子微粒,且带一个单位负电荷,则C是OH-;
D是多核10电子分子,D是极性键构成的4原子极性分子,则D是NH3;
E是单核带2个单位正电荷的10电子阳离子,则E是Mg2+;F是多核带1个单位正电荷的10电子阳离子,且C常用作F的检出(加热),则F是NH4+;G为多核10电子分子,G可能为H2O或CH4,据此答题.
解答:
解:A是单核且含有10电子的微粒,则A是Ne;B是单核且带1个单位正电荷的离子,电子数为10,则B是Na+;C是双核10电子微粒,且带一个单位负电荷,则C是OH-;D是多核10电子分子,D是极性键构成的4原子极性分子,则D是NH3;E是单核带2个单位正电荷的10电子阳离子,则E是Mg2+;F是多核带1个单位正电荷的10电子阳离子,且C常用作F的检出(加热),则F是NH4+;G为多核10电子分子,G可能为H2O或CH4,
(1)A为Ne,Ne原子核外有2个电子层、最外层电子数是8,则Ne原子结构示意图为: ,
,
故答案为: ;
;
(2)金属性:Na>Mg,元素的金属性越强,对应的最高价氧化物的水化物的碱性越强,则碱性:NaOH>Mg(OH)2,
故答案为:NaOH;Mg(OH)2;
(3)F为铵根离子,F与G能够发生反应,甲烷与铵根离子不反应,则F只能为水,铵根离子与水反应的离子方程式为:NH4++H2O?NH3?H2O+H+,
故答案为:NH4++H2O?NH3?H2O+H+.
(1)A为Ne,Ne原子核外有2个电子层、最外层电子数是8,则Ne原子结构示意图为:
 ,
,故答案为:
 ;
;(2)金属性:Na>Mg,元素的金属性越强,对应的最高价氧化物的水化物的碱性越强,则碱性:NaOH>Mg(OH)2,
故答案为:NaOH;Mg(OH)2;
(3)F为铵根离子,F与G能够发生反应,甲烷与铵根离子不反应,则F只能为水,铵根离子与水反应的离子方程式为:NH4++H2O?NH3?H2O+H+,
故答案为:NH4++H2O?NH3?H2O+H+.
点评:本题考查元素周期表和周期律知识,题目难度中等,正确推断元素的种类为解答该题的关键,注意掌握元素周期表结构、元素周期律的递变规律,试题有利于培养学生的分析、理解能力及灵活应用所学知识的能力.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
对水的电离平衡不产生影响的粒子是( )
A、 |
B、 |
| C、26R3+ |
D、 |
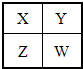 已知X、Y、Z、W四种短周期主族元素在周期表中的相对位置如图所示,下列说法不正确的是( )
已知X、Y、Z、W四种短周期主族元素在周期表中的相对位置如图所示,下列说法不正确的是( )| A、Y原子形成的简单离子半径一定比X原子形成的简单离子半径大 |
| B、W的原子序数可能是Y的原子序数的3倍 |
| C、Y的气态氢化物的稳定性一定比W的强 |
| D、若Z元素最高价氧化物的水化物是强酸,则W元素的单质具有强氧化性 |
若想用沉淀法测定硝酸银的浓度,下列沉淀剂中,效果最好的是( )
| A、氯化钠溶液 |
| B、溴化钠溶液 |
| C、硫酸钠溶液 |
| D、硫化钠溶液 |
1mol 某烃完全燃烧后,能生成二氧化碳112L(标准状况下),此烃在一定条件下能与氢气加成,最多能消耗两倍于其体积的氢气,则此烃的结构简式可能为( )
| A、CH3-CH=CH2 |
| B、CH3-CH=CH-CH=CH2 |
| C、CH3-CH=CH-CH2-CH3 |
| D、CH2=CH2 |