题目内容
热化学方程式的书写.
①已知0.4mol液态肼和足量H2O2反应,生成氮气和水蒸气,放出256.65kJ的热量.写出该反应的热化学方程式 .
②已知化学方程式:H2(g)+
O2(g)=H2O(g),该反应的活化能为167.2kJ/mol,其逆反应的活化能为409.0kJ/mol,写出该反应的热化学方程式
③已知1mol白磷转变成相应物质量的红磷时放出29.2KJ热量,写出该反应的热化学方程式 .
④已知S(s)+O2(g)?SO2(g) 当有4NA个电子转移时,放出297.23kJ的热量.写出该反应的热化学方程式 .
⑤1克CH4完全燃烧生成CO2和H2O时,放出Q kJ的热量.写出此反应的热化学方程式 .
⑥酒精燃烧的化学方程式为:C2H6O(l)+3O2(g)=2CO2(g)+3H2O(l),完全燃烧一定量的无水酒精,放出的热量为Q kJ,当完全吸收生成的CO2,消耗8mol/L的NaOH溶液50mL时恰好生成正盐.写出此反应的热化学方程式 .
①已知0.4mol液态肼和足量H2O2反应,生成氮气和水蒸气,放出256.65kJ的热量.写出该反应的热化学方程式
②已知化学方程式:H2(g)+
| 1 |
| 2 |
③已知1mol白磷转变成相应物质量的红磷时放出29.2KJ热量,写出该反应的热化学方程式
④已知S(s)+O2(g)?SO2(g) 当有4NA个电子转移时,放出297.23kJ的热量.写出该反应的热化学方程式
⑤1克CH4完全燃烧生成CO2和H2O时,放出Q kJ的热量.写出此反应的热化学方程式
⑥酒精燃烧的化学方程式为:C2H6O(l)+3O2(g)=2CO2(g)+3H2O(l),完全燃烧一定量的无水酒精,放出的热量为Q kJ,当完全吸收生成的CO2,消耗8mol/L的NaOH溶液50mL时恰好生成正盐.写出此反应的热化学方程式
考点:有关反应热的计算,热化学方程式
专题:
分析:①计算1mol液态肼与足量液态双氧水反应时放出的热量,可写出反应的热化学方程式;
②逆反应的反应热=正反应活化能-逆反应活化能;
③1mol白磷固体会生成4mol的红磷固体,放出29.2KJ热量,可写出反应的热化学方程式;
④当有4NA个电子转移时,反应的硫和氧气,生成的二氧化硫都是1mol,标注物质聚集状态和对应焓变写出热化学方程式;
⑤根据热化学方程式的书写方法可知,化学计量数与反应热成正比,并注意标明物质的聚集状态来解答;
⑥根据CO2与NaOH溶液反应,计算出CO2的物质的量,进而计算出乙醇的物质的量,根据乙醇的物质的量和热量的关系求出,可写出反应的热化学方程式.
②逆反应的反应热=正反应活化能-逆反应活化能;
③1mol白磷固体会生成4mol的红磷固体,放出29.2KJ热量,可写出反应的热化学方程式;
④当有4NA个电子转移时,反应的硫和氧气,生成的二氧化硫都是1mol,标注物质聚集状态和对应焓变写出热化学方程式;
⑤根据热化学方程式的书写方法可知,化学计量数与反应热成正比,并注意标明物质的聚集状态来解答;
⑥根据CO2与NaOH溶液反应,计算出CO2的物质的量,进而计算出乙醇的物质的量,根据乙醇的物质的量和热量的关系求出,可写出反应的热化学方程式.
解答:
解:①0.4mol液态肼和足量H2O2反应,生成氮气和水蒸气,放出256.65kJ的热量,1mol液态肼与足量液态双氧水反应时放出的热量641.625kJ,则热化学方程式为:N2H4(l)+2H2O2(l)═N2(g)+4H2O(g)△H=-641.625 kJ?mol-1,
故答案为:N2H4(l)+2H2O2(l)═N2(g)+4H2O(g)△H=-641.625 kJ?mol-1;
②逆反应的反应热=逆反应活化能-正反应活化能=409.0kJ/mol-167.2kJ/mol=+241.8KJ/mol-1,该反应热化学方程式为H2O(g)=H2(g)+1/2O2(g)△H=+241.8KJ/mol-1;
故答案为:H2O(g)=H2(g)+1/2O2(g)△H=+241.8KJ/mol-1;
③1mol白磷固体会生成4mol的红磷固体,放出29.2KJ热量,则该反应的热化学方程式为P4(S,白磷)═4P(S,红磷)△H=-29.2KJ/mol-1;
故答案为:P4(S,白磷)═4P(S,红磷)△H=-29.2KJ/mol-1;
④已知S(s)+O2(g)?SO2(g) 当有4NA个电子转移时,放出297.23kJ的热量,该反应的热化学方式为:S(s)+O2(g)?SO2(g)△H=-297.23KJ/mol;
故答案为:S(s)+O2(g)?SO2(g)△H=-297.23KJ?mol-1;
⑤1gCH4在氧气中燃烧生成CO2和液态水,放出QkJ热量,16g即1molCH4在氧气中燃烧生成CO2和液态水,放出16QkJ热量,则热化学方程式为:CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=-16QkJ?mol-1;
故答案为:CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=-16Q kJ?mol-1;
⑥8mol/L的NaOH溶液50ml:n(NaOH)=0.05L×8mol/L=0.4mol,CO2与NaOH溶液反应:2NaOH+CO2═Na2CO3+H2O,则由CO2~2NaOH可知,n(CO2)=0.2mol,则n(C2H6O)=
×n(CO2)=0.1mol,放出的热量为Q,所以1mol乙醇完全燃烧放出的热量为10Q,此反应的热化学方程式为C2H6O(l)+3O2(g)=2CO2(g)+3H2O(l)△H=-10Q kJ?mol-1.
故答案为:C2H6O(l)+3O2(g)=2CO2(g)+3H2O(l)△H=-10Q kJ?mol-1.
故答案为:N2H4(l)+2H2O2(l)═N2(g)+4H2O(g)△H=-641.625 kJ?mol-1;
②逆反应的反应热=逆反应活化能-正反应活化能=409.0kJ/mol-167.2kJ/mol=+241.8KJ/mol-1,该反应热化学方程式为H2O(g)=H2(g)+1/2O2(g)△H=+241.8KJ/mol-1;
故答案为:H2O(g)=H2(g)+1/2O2(g)△H=+241.8KJ/mol-1;
③1mol白磷固体会生成4mol的红磷固体,放出29.2KJ热量,则该反应的热化学方程式为P4(S,白磷)═4P(S,红磷)△H=-29.2KJ/mol-1;
故答案为:P4(S,白磷)═4P(S,红磷)△H=-29.2KJ/mol-1;
④已知S(s)+O2(g)?SO2(g) 当有4NA个电子转移时,放出297.23kJ的热量,该反应的热化学方式为:S(s)+O2(g)?SO2(g)△H=-297.23KJ/mol;
故答案为:S(s)+O2(g)?SO2(g)△H=-297.23KJ?mol-1;
⑤1gCH4在氧气中燃烧生成CO2和液态水,放出QkJ热量,16g即1molCH4在氧气中燃烧生成CO2和液态水,放出16QkJ热量,则热化学方程式为:CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=-16QkJ?mol-1;
故答案为:CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=-16Q kJ?mol-1;
⑥8mol/L的NaOH溶液50ml:n(NaOH)=0.05L×8mol/L=0.4mol,CO2与NaOH溶液反应:2NaOH+CO2═Na2CO3+H2O,则由CO2~2NaOH可知,n(CO2)=0.2mol,则n(C2H6O)=
| 1 |
| 2 |
故答案为:C2H6O(l)+3O2(g)=2CO2(g)+3H2O(l)△H=-10Q kJ?mol-1.
点评:本题主要考查了热化学方程式的书写,需要注意的有:物质的状态、反应热的数值与单位,反应热的数值与化学方程式前面的系数成正比,题目难度不大.

练习册系列答案
相关题目
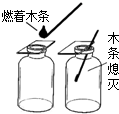 观察如图中的有关操作和现象,判断下列叙述正确的是( )
观察如图中的有关操作和现象,判断下列叙述正确的是( )| A、集气瓶中的气体可能是CO2 |
| B、集气瓶中的气体可能是空气 |
| C、集气瓶中的气体一定是O2 |
| D、集气瓶中的气体一定是N2 |
下列物质的转化在给定条件下能实现的是( )
①Al2O3
NaAlO2(aq)
Al(OH)3
②S
SO3
H2SO4
③NaHCO3溶液
NaHCO3
Na2CO3
④Fe2O3
FeCl3(aq)
无水FeCl3
⑤MgCl2(aq)
Mg(OH)2
MgO.
①Al2O3
| NaOH(aq) |
| △ |
| CO2 |
②S
| O2/点燃 |
| H2O |
③NaHCO3溶液
| 蒸干 |
| △ |
④Fe2O3
| HCl(aq) |
| △ |
⑤MgCl2(aq)
| 石灰乳 |
| 煅烧 |
| A、①③⑤ | B、②③④ |
| C、②④⑤ | D、①④⑤ |
可逆反应:mA(固)+nB(气)?eC(气)+fD(气),反应过程中,当其他条件不变时,C 的体积分数(C%)与温度T和压强P的 关系如图.下列叙述正确的是( )


| A、达到平衡后,加入催化剂C%增大 |
| B、达到平衡后,若升温平衡向左移 |
| C、m+n<e+f |
| D、达平衡后,若降压平衡向左移动 |
在地壳内,深度每增加1km 增加25250~30300kPa,在这样的压强下,对固体物质的平衡会发生较大的影响.如:CaAl2Si2O8+Mg2SiO4═CaMg2Al2Si3O12
(钙长石) (镁橄榄石)(钙镁)石榴子石
在地壳区域变质的高压条件下,有利于( )
(钙长石) (镁橄榄石)(钙镁)石榴子石
| 摩尔质量(g/mol) | 278 | 140.6 | 413.6 |
| 密度(g/cm3) | 2.70 | 3.22 | 3.50 |
| A、钙长石生成 |
| B、镁橄榄石生成 |
| C、钙长石和镁橄榄石共存 |
| D、(钙镁)石榴子石生成 |
下列说法不正确的是( )
| A、硫粉在过量的纯氧中燃烧可以生成大量的SO2 |
| B、可以用品红溶液鉴别SO2和CO2 |
| C、SO2能使品红溶液、酸性KMnO4溶液褪色,但褪色原理不同 |
| D、少量SO2通过CaCl2的溶液能生成白色沉淀 |
X、Y、Z、W为四种短周期主族元素,它们在周期表中的位置如图所示.W元素的简单离子半径在同周期元素的简单离子中最小.下列说法中正确的是( )
| X | Y | ||
| Z | W |
| A、原子半径由小到大的顺序为:Y<X<W<Z |
B、X元素最高价氧化物分子的比例模型为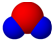 |
| C、Z单质与X元素最高价氧化物、Y单质都能反应,体现氧化性 |
| D、W的单质在地壳含量丰富,工业上可通过电解它的无水盐来制备. |