题目内容
Na2SO4和Na2CO3的混合溶液中加入过量的BaCl2溶液,得到14.51g白色沉淀,向白色沉淀中再加入过量的稀HCl,充分反应后,沉淀减少到4.66g,并有气体产生.
(1)写出有关化学反应方程式.
(2)原混合物溶液中Na2SO4和Na2CO3的物质的量各是多少?
(3)产生的气体在标准状况下的体积是多少升?
(1)写出有关化学反应方程式.
(2)原混合物溶液中Na2SO4和Na2CO3的物质的量各是多少?
(3)产生的气体在标准状况下的体积是多少升?
考点:有关混合物反应的计算
专题:计算题
分析:(1)硫酸钠、碳酸钠都能够与氯化钡溶液反应,分别生成碳酸钡、硫酸钡沉淀,沉淀中进入稀盐酸后,碳酸钡能够与盐酸反应生成氯化钡和二氧化碳气体,据此写出反应的化学方程式;
(2)14.51克白色沉淀是BaCO3和BaSO4混合物,BaSO4不溶于水与硝酸,BaCO3溶于硝酸,故白色沉淀中加入过量的稀盐酸,充分反应后,沉淀减少到4.66g为BaSO4的质量,可得BaCO3的质量为14.51g-4.66g=9.85g,根据n=
计算BaCO3和BaSO4的物质的量,Na2SO4的物质的量等同于BaSO4的物质的量,Na2CO3的物质的量等同于BaCO3的物质的量;
(3)发生反应BaCO3+2HCl═BaCl2+H2O+CO2↑,由方程式可知n(CO2)=n(BaCO3),再根据V=nVm计算CO2的体积.
(2)14.51克白色沉淀是BaCO3和BaSO4混合物,BaSO4不溶于水与硝酸,BaCO3溶于硝酸,故白色沉淀中加入过量的稀盐酸,充分反应后,沉淀减少到4.66g为BaSO4的质量,可得BaCO3的质量为14.51g-4.66g=9.85g,根据n=
| m |
| M |
(3)发生反应BaCO3+2HCl═BaCl2+H2O+CO2↑,由方程式可知n(CO2)=n(BaCO3),再根据V=nVm计算CO2的体积.
解答:
解:(1)硫酸钠与氯化钡反应生成硫酸钡沉淀,反应的离子方程式为:Na2SO4+BaCl2=BaSO4↓+2NaCl;
碳酸钠与氯化钡溶液反应生成碳酸钡沉淀,反应的化学方程式为:BaCl2+Na2CO3=2NaCl+BaCO3↓,
碳酸钡溶于稀盐酸,反应的化学方程式为:BaCO3+2HCl═BaCl2+H2O+CO2↑,
答:有关反应的化学方程式有:Na2SO4+BaCl2=BaSO4↓+2NaCl、BaCl2+Na2CO3=2NaCl+BaCO3↓、BaCO3+2HCl═BaCl2+H2O+CO2↑;
(2)14.51克白色沉淀是BaCO3和BaSO4混合物,加入过量的稀盐酸,充分反应后,剩余沉淀4.66g为BaSO4,BaSO4的物质的量为:
=0.02mol,
由硫酸根守恒可知:n(Na2SO4)=n(BaSO4)=0.02mol,
减少的沉淀质量为BaCO3,故BaCO3的质量为:14.51g-4.66g=9.85g,碳酸钡的物质的量为:
=0.05mol,
由碳酸根守恒可知n(Na2CO3)=n(BaCO3)=0.05mol,
答:原混和溶液中Na2SO4和Na2CO3的物质的量分别为0.02mol、0.05mol;
(2)发生反应BaCO3+2HCl═BaCl2+H2O+CO2↑,由方程式可知:n(CO2)=n(BaCO3)=0.05mol,
故生成的二氧化碳的体积为:0.05mol×22.4L/mol=1.12L,
答:产生的气体在标准状况下的体积为1.12L.
碳酸钠与氯化钡溶液反应生成碳酸钡沉淀,反应的化学方程式为:BaCl2+Na2CO3=2NaCl+BaCO3↓,
碳酸钡溶于稀盐酸,反应的化学方程式为:BaCO3+2HCl═BaCl2+H2O+CO2↑,
答:有关反应的化学方程式有:Na2SO4+BaCl2=BaSO4↓+2NaCl、BaCl2+Na2CO3=2NaCl+BaCO3↓、BaCO3+2HCl═BaCl2+H2O+CO2↑;
(2)14.51克白色沉淀是BaCO3和BaSO4混合物,加入过量的稀盐酸,充分反应后,剩余沉淀4.66g为BaSO4,BaSO4的物质的量为:
| 4.66g |
| 233g/mol |
由硫酸根守恒可知:n(Na2SO4)=n(BaSO4)=0.02mol,
减少的沉淀质量为BaCO3,故BaCO3的质量为:14.51g-4.66g=9.85g,碳酸钡的物质的量为:
| 9.85g |
| 197g/mol |
由碳酸根守恒可知n(Na2CO3)=n(BaCO3)=0.05mol,
答:原混和溶液中Na2SO4和Na2CO3的物质的量分别为0.02mol、0.05mol;
(2)发生反应BaCO3+2HCl═BaCl2+H2O+CO2↑,由方程式可知:n(CO2)=n(BaCO3)=0.05mol,
故生成的二氧化碳的体积为:0.05mol×22.4L/mol=1.12L,
答:产生的气体在标准状况下的体积为1.12L.
点评:本题考查了混合物反应的计算、反应方程式的书写,正确书写有关反应的化学方程式为解答本题的关键,注意明确硫酸钡、碳酸钡的化学性质,本题难易适中,使用到质量较好的化学计算题.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
下列说法中正确的是( )
| A、某固体在加入稀盐酸产生了无色无味且能使澄清石灰水变浑的气体,证明该固体一定含有CO32- |
| B、某无色溶液滴加酚酞试液显红色,该溶液不一定是碱 |
| C、加入氯化钡溶液有白色沉淀产生,再加盐酸,沉淀不消失,一定有SO42- |
| D、某溶液与NaOH溶液共热,产生使湿润蓝色石蕊试纸变红气体,说明原溶液中存在NH4+ |
下列实验操作中错误的是( )
| A、蒸发操作时,应使混合物中的水分完全蒸干后,才能停止加热 |
| B、蒸馏操作时,应使温度计水银球靠近蒸馏烧瓶的支管口处 |
| C、分液操作时,分液漏斗下层液体应从下口放出,上层液体应从上口倒出 |
| D、萃取操作时,所选萃取剂溶解溶质能力应大于原溶剂且与原溶剂互不相溶 |
下列物质长期放置在空气中容易变质,但不属于氧化还原反应的是( )
| A、CaO |
| B、Na2O2 |
| C、Na2SO3 |
| D、FeSO4 |

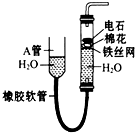 如图中的实验装置可用于制取乙炔.请填空:
如图中的实验装置可用于制取乙炔.请填空: