题目内容
X、Y、Z、W为四种短周期主族元素,它们在周期表中的位置如图所示.W元素的简单离子半径在同周期元素的简单离子中最小.下列说法中正确的是( )
| X | Y | ||
| Z | W |
| A、原子半径由小到大的顺序为:Y<X<W<Z |
B、X元素最高价氧化物分子的比例模型为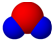 |
| C、Z单质与X元素最高价氧化物、Y单质都能反应,体现氧化性 |
| D、W的单质在地壳含量丰富,工业上可通过电解它的无水盐来制备. |
考点:元素周期律和元素周期表的综合应用
专题:
分析:X、Y、Z、W为四种短周期主族元素,根据元素在周期表中的位置知,X、Y属于第二周期元素,Z和W属于第三周期元素,W元素的简单离子半径在同周期元素的简单离子中最小,则W是Al元素,则Z是Mg元素、X是C元素、Y是N元素,
A.原子的电子层数越多其原子半径越大,同一周期元素,原子半径随着原子序数增大而减小;
B.X的最高价氧化物是二氧化碳,为直线型分子;
C.Mg和二氧化碳、氮气都能发生化合反应;
D.氯化铝属于分子晶体,熔融状态下不导电.
A.原子的电子层数越多其原子半径越大,同一周期元素,原子半径随着原子序数增大而减小;
B.X的最高价氧化物是二氧化碳,为直线型分子;
C.Mg和二氧化碳、氮气都能发生化合反应;
D.氯化铝属于分子晶体,熔融状态下不导电.
解答:
解:根据四种短周期主族元素X、Y、Z、W在周期表中的位置判断X、Y在第二周期,Z、W在第三周期,W元素的简单离子半径在同周期元素的简单离子中最小得到W是铝元素,X、Y、Z分别是碳、氮、镁元素,
A.根据同周期左到右元素的原子半径减小,同主族上到下元素的原子半径增大,原子半径由小到大的顺序为:Y<X<W<Z,故A正确;
B.X元素最高价氧化物分子是二氧化碳,二氧化碳是直线型分子,故B错误;
C.Z单质镁与X元素最高价氧化物二氧化碳、Y单质氮气都能反应,得到镁的化合物,体现镁的还原化性,故C错误;
D、铝以化合态形式存在,工业上可通过电解熔融氧化铝来制备铝,故D错误;
故选A.
A.根据同周期左到右元素的原子半径减小,同主族上到下元素的原子半径增大,原子半径由小到大的顺序为:Y<X<W<Z,故A正确;
B.X元素最高价氧化物分子是二氧化碳,二氧化碳是直线型分子,故B错误;
C.Z单质镁与X元素最高价氧化物二氧化碳、Y单质氮气都能反应,得到镁的化合物,体现镁的还原化性,故C错误;
D、铝以化合态形式存在,工业上可通过电解熔融氧化铝来制备铝,故D错误;
故选A.
点评:本题考查了元素周期表元素周期律,以W元素的简单离子半径在同周期元素的简单离子中最小为突破口得到X、Y、Z、W分别是哪种元素是关键,再结合物质结构、物质性质分析解答,易错选项是D,注意氯化铝属于共价化合物而不是离子化合物,为易错点.

练习册系列答案
 小天才课时作业系列答案
小天才课时作业系列答案 一课四练系列答案
一课四练系列答案 黄冈小状元满分冲刺微测验系列答案
黄冈小状元满分冲刺微测验系列答案 新辅教导学系列答案
新辅教导学系列答案
相关题目
下列物质长期放置在空气中容易变质,但不属于氧化还原反应的是( )
| A、CaO |
| B、Na2O2 |
| C、Na2SO3 |
| D、FeSO4 |
某无色溶液能溶解Al(OH)3,则此溶液中一定能大量共存的离子组是( )
| A、Fe2+、Cl-、Na+、NO3- |
| B、K+、Na+、NO3-、HCO3- |
| C、Na+、Ba2+、Cl-、NO3- |
| D、Na+、K+、AlO2-、SO42- |
蒸发操作中必须用到蒸发皿,下列有关蒸发皿的操作中,正确的是( )
| A、将蒸发皿放置在铁架台的铁圈上直接用酒精灯火焰加热 |
| B、将蒸发皿放置在铁架台的铁圈上,并加垫石棉网加热 |
| C、用手持着蒸发皿直接用酒精灯火焰加热 |
| D、将灼热的蒸发皿直接用冷水冲洗 |
在汽车加油站见到的油罐车上,所贴的危险化学品标志是( )
A、 |
B、 |
C、 |
D、 |
用NA表示阿伏加德罗常数的值.下列判断正确的是( )
| A、18gH2O含有的氢原子数目为NA |
| B、标准状况下,22.4LH2O含有的分子数目为NA |
| C、24g Mg变为Mg2+时失去的电子数为NA |
| D、常温常压下,71gCl2中含有的分子数为NA |