题目内容
20.短周期主族元素A、B、X、Y的原子序数依次增大,A、B、X、Y原子的最外层电子数之和为18,A原子的最外层电子数是其内层电子数的2倍,X2+与B2-具有相同的电子层结构.下列说法正确的是( )| A. | 单质的沸点:B>X | |
| B. | B、X、Y的原子半径大小顺序为:X>Y>B | |
| C. | A的最高价氧化物对应的水化物的酸性强于Y的 | |
| D. | B分别与X、Y形成的化合物中化学键类型相同 |
分析 短周期主族元素A、B、X、Y的原子序数依次增大,A原子的最外层电子数是其内层电子数的2倍,A为C元素;X2+与B2-具有相同的电子层结构,X为Mg元素,B为O元素;A、B、X、Y原子的最外层电子数之和为18,则Y的最外层电子数为18-4-2-6=6,则Y为S元素,以此来解答.
解答 解:由上述分析可知,A为C,B为O,X为Mg,Y为S,
A.常温下Mg为固体,氧气为气体,则单质的沸点:B<X,故A错误;
B.电子层越多,原子半径越大,同周期从左向右原子半径减小,则B、X、Y的原子半径大小顺序为:X>Y>B,故B正确;
C.非金属性S>C,A的最高价氧化物对应的水化物的酸性弱于Y的,故C错误;
D.MgO只含离子键,二氧化硫含共价键,故D错误;
故选B.
点评 本题考查原子结构与元素周期律,为高频考点,把握原子结构、元素的位置推断元素为解答的关键,侧重分析与应用能力的考查,注意规律性知识的应用,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
3.化学在生活中有着广泛的应用.下列对应关系错误的是( )
| 选项 | 化学性质 | 实际应用 |
| A | ClO2具有强氧化性 | 自来水消毒杀菌 |
| B | SO2具有还原性 | 用作漂白剂 |
| C | NaHCO3受热分解并且生成气体 | 焙制糕点 |
| D | Al(OH)3分解吸收大量热量并有H2O生成 | 阻燃胶合板 |
| A. | A | B. | B | C. | C | D. | D |
11.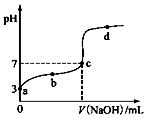 某温度时,CH3COOH电离的平衡常数为K.该温度下向20mL0.1mol•L-1 CH3COOH溶液中逐滴加入0.1mol•L-1 NaOH溶液,其pH变化曲线如图(忽略温度变化).下列说法不正确的是( )
某温度时,CH3COOH电离的平衡常数为K.该温度下向20mL0.1mol•L-1 CH3COOH溶液中逐滴加入0.1mol•L-1 NaOH溶液,其pH变化曲线如图(忽略温度变化).下列说法不正确的是( )
 某温度时,CH3COOH电离的平衡常数为K.该温度下向20mL0.1mol•L-1 CH3COOH溶液中逐滴加入0.1mol•L-1 NaOH溶液,其pH变化曲线如图(忽略温度变化).下列说法不正确的是( )
某温度时,CH3COOH电离的平衡常数为K.该温度下向20mL0.1mol•L-1 CH3COOH溶液中逐滴加入0.1mol•L-1 NaOH溶液,其pH变化曲线如图(忽略温度变化).下列说法不正确的是( )| A. | a点表示溶液c(CH3COO-)=10-3 mol•L-1 | |
| B. | b点表示溶液c(CH3COO-)>c( Na+) | |
| C. | c点表示溶液c(CH3COO-)=c( Na+),此时,CH3COOH和NaOH恰好完全中和 | |
| D. | b、d点时CH3COOH的电离平衡常数K均为1.0×10-5 |
15.SO2的水溶液中加BaCl2无沉淀,若再加入物质X,则出现白色沉淀.X不可以是( )
| A. | H2O2 | B. | NH3 | C. | HCl | D. | NaOH |
5.下列实验中,对应的观象以及结论都正确且两者具有因果关系的是结论( )
| 选项 | 实验 | 现象 | 结论 |
| A | 将苯滴加到溴水中 | 溴水褪色 | 苯和溴发生了取代反应 |
| B | 将CO2通入CaCl2溶液中 | 溶液中有白色沉淀出现 | 生成的CaCO3难溶于水 |
| C | 用NO2气体做喷泉实验 | 液体充满烧瓶 | NO2完全溶于水 |
| D | 向氯化铵溶液中投入一铝片 | 铝片上产生大量气泡 | 氯化铵溶液显酸性,产生了 |
| A. | A | B. | B | C. | C | D. | D |
11.某温度下,已知Ksp(BaSO4 )=1.1×10-10,Ksp(BaCO3)=2.5×10-9.下列说法正确的是( )
| A. | BaSO4比BaCO3溶解度小,所以BaCO3不可能转化为BaSO4 | |
| B. | BaCO3、BaSO4均不溶于水,所以都可以做钡餐试剂 | |
| C. | 该温度下,BaCO3若要在Na2SO4溶液中转化为BaSO4,则Na2SO4浓度至少为2.2×10-6 mol•L | |
| D. | 任何温度下,向Na2CO3溶液中加入BaCl2和Na2SO4,当两种沉淀共存时,c(SO42-)/c(CO32-)=4.4×10-3 |
12.《中华人民共和国安全生产法》指出安全生产工作应当以人为本,坚持安全发展、预防为主、综合治理的方针.下列做法不正确的是( )
| A. | 面粉生产车间应严禁烟火 | |
| B. | NH3泄露时向空中喷洒水雾 | |
| C. | 含Cl2的尾气用碱溶液处理后再排放 | |
| D. | 金属钠失火时应立即用大量冷水扑灭 |
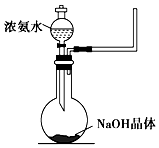 氨气是一种重要的工业产品,也是一种重要的化工原料.为研究氨气的制备及性质,某学习小组进行了下面的探究活动:
氨气是一种重要的工业产品,也是一种重要的化工原料.为研究氨气的制备及性质,某学习小组进行了下面的探究活动: