题目内容
11.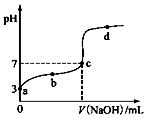 某温度时,CH3COOH电离的平衡常数为K.该温度下向20mL0.1mol•L-1 CH3COOH溶液中逐滴加入0.1mol•L-1 NaOH溶液,其pH变化曲线如图(忽略温度变化).下列说法不正确的是( )
某温度时,CH3COOH电离的平衡常数为K.该温度下向20mL0.1mol•L-1 CH3COOH溶液中逐滴加入0.1mol•L-1 NaOH溶液,其pH变化曲线如图(忽略温度变化).下列说法不正确的是( )| A. | a点表示溶液c(CH3COO-)=10-3 mol•L-1 | |
| B. | b点表示溶液c(CH3COO-)>c( Na+) | |
| C. | c点表示溶液c(CH3COO-)=c( Na+),此时,CH3COOH和NaOH恰好完全中和 | |
| D. | b、d点时CH3COOH的电离平衡常数K均为1.0×10-5 |
分析 A.a点pH=3,由CH3COOH?CH3COO-+H+分析;
B.b点溶液显酸性,由电荷守恒分析;
C.醋酸和氢氧化钠恰好反应生成盐醋酸钠溶液显碱性,c点溶液的pH=7说明为醋酸和醋酸钠的混合溶液;
D.b、d 点温度不变,则K不变.
解答 解:A.a点pH=3,由CH3COOH?CH3COO-+H+可知,c(H+)=c(CH3COO-)=10-3mol/L,故A正确;
B.b点溶液显酸性,c(H+)>c(OH-),由电荷守恒可知,c(Na+)+c(H+)=c(CH3COO-)+c(OH-),c(Na+)<c(CH3COO-),故B正确;
C.c点溶液的pH=7,若CH3COOH和NaOH恰好反应完全生成醋酸钠,溶液的pH>7,应醋酸剩余,故C错误;
D.b、d 点温度不变,则K不变,pH=3的溶液中Ka=$\frac{c(C{H}_{3}CO{O}^{-})c({H}^{+})}{c(C{H}_{3}COOH)}$=$\frac{1{0}^{-3}×1{0}^{-3}}{0.1}$=10-5,故D正确;
故选C.
点评 本题考查了酸碱混合的定性判断、离子浓度大小比较,题目难度中等,注意平衡常数K只与温度有关,与其它任何条件都无关,能够根据电荷守恒、物料守恒比较溶液中离子浓度大小.

练习册系列答案
 名牌学校分层周周测系列答案
名牌学校分层周周测系列答案 黄冈海淀全程培优测试卷系列答案
黄冈海淀全程培优测试卷系列答案
相关题目
14.设NA为阿伏伽德罗常数的值,下列说法正确的是( )
| A. | 标准状况下,含NA个分子的H2、CO混合气体的体积约为22.4L | |
| B. | 56g铁与一定量的氯气在一定条件下充分反应,转移的电子数一定是3NA | |
| C. | 28g乙烯与C3H8的混合物中含有C-H键的数目为4NA | |
| D. | 常温下,pH=11的NaOH溶液中由水电离出的H+数目为0.001NA |
2.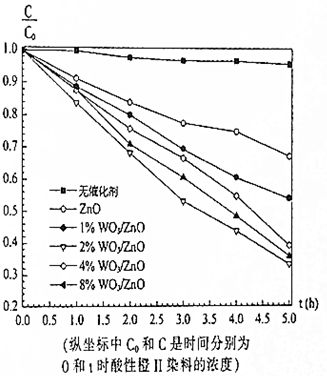 在紫外光照射下,利用WO3/ZnO光催化剂降解酸性橙Ⅱ染料废水的实验所得曲线如图.下列说法错误的是( )
在紫外光照射下,利用WO3/ZnO光催化剂降解酸性橙Ⅱ染料废水的实验所得曲线如图.下列说法错误的是( )
 在紫外光照射下,利用WO3/ZnO光催化剂降解酸性橙Ⅱ染料废水的实验所得曲线如图.下列说法错误的是( )
在紫外光照射下,利用WO3/ZnO光催化剂降解酸性橙Ⅱ染料废水的实验所得曲线如图.下列说法错误的是( )| A. | 不加催化剂时,紫外光照射降解酸性橙Ⅱ染料废水反应速率较慢 | |
| B. | 单一ZnO材料也是降解酸性橙Ⅱ染料废水的催化剂 | |
| C. | 2%WO3/ZnO的催化效果最好 | |
| D. | 由图中可以看出,光降解酸性橙Ⅱ染料是一个可逆反应 |
19.通常状况下和氨气不能共存的气体是( )
| A. | 氧气 | B. | 氯化氢气体 | C. | 氢气 | D. | 一氧化碳气体 |
6.下列说法中正确的是( )
| A. | 氮气分子中含有1个σ键和2个π键 | |
| B. | 乙烯中C=C的键能是乙烷中C-C的键能的2倍 | |
| C. | N-O键的极性比C-O键的极性大 | |
| D. | NH4+中4个N-H键的键能不相同 |
16.已知H2(g)+Br2(g)═2HBr(g);1mol完全反应放出热量72KJ,其他相关数据如表:则表中a为( )
| H2(g) | Br2(g) | HBr(g) | |
| 1mol分子中的化学键断裂时需要吸收的能量/kJ | 436 | a | 369 |
| A. | 404 | B. | 230 | C. | 200 | D. | 260 |
20.短周期主族元素A、B、X、Y的原子序数依次增大,A、B、X、Y原子的最外层电子数之和为18,A原子的最外层电子数是其内层电子数的2倍,X2+与B2-具有相同的电子层结构.下列说法正确的是( )
| A. | 单质的沸点:B>X | |
| B. | B、X、Y的原子半径大小顺序为:X>Y>B | |
| C. | A的最高价氧化物对应的水化物的酸性强于Y的 | |
| D. | B分别与X、Y形成的化合物中化学键类型相同 |
3.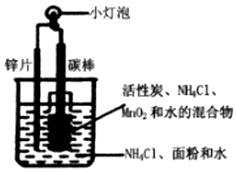 干电池模拟实验装置如图.下列说法不正确的是( )
干电池模拟实验装置如图.下列说法不正确的是( )
 干电池模拟实验装置如图.下列说法不正确的是( )
干电池模拟实验装置如图.下列说法不正确的是( )| A. | 碳棒作正极,锌片作负极 | |
| B. | 电流方向从碳棒流向锌片,电子则相反 | |
| C. | NH4Cl是电解质,在锌片逐渐消耗过程中 MnO2不断被还原 | |
| D. | 该电池是二次电池,该废旧电池中锌可回收 |