题目内容
11.某温度下,已知Ksp(BaSO4 )=1.1×10-10,Ksp(BaCO3)=2.5×10-9.下列说法正确的是( )| A. | BaSO4比BaCO3溶解度小,所以BaCO3不可能转化为BaSO4 | |
| B. | BaCO3、BaSO4均不溶于水,所以都可以做钡餐试剂 | |
| C. | 该温度下,BaCO3若要在Na2SO4溶液中转化为BaSO4,则Na2SO4浓度至少为2.2×10-6 mol•L | |
| D. | 任何温度下,向Na2CO3溶液中加入BaCl2和Na2SO4,当两种沉淀共存时,c(SO42-)/c(CO32-)=4.4×10-3 |
分析 A.同类型的难溶电解质,Ksp小的溶解度小,但Qc>Ksp时生成沉淀;
B.BaSO4不溶于盐酸,可以做钡餐试剂;
C.BaCO3若要在Na2SO4溶液中转化为BaSO4,c(Na2SO4)×$\sqrt{Ksp(BaC{O}_{3})}$>Ksp(BaSO4 );
D.当两种沉淀共存时,$\frac{c(S{{O}_{4}}^{2-})}{c(C{{O}_{3}}^{2-})}$=$\frac{Ksp(BaS{O}_{4})}{Ksp(BaC{O}_{3})}$.
解答 解:A.同类型的难溶电解质,Ksp小的溶解度小,但Qc>Ksp时生成沉淀,则BaSO4比BaCO3溶解度小,但BaCO3可能转化为BaSO4,故A错误;
B.BaSO4不溶于盐酸,可以做钡餐试剂,而BaCO3溶于盐酸,不能做钡餐试剂,故B错误;
C.BaCO3若要在Na2SO4溶液中转化为BaSO4,c(Na2SO4)×$\sqrt{Ksp(BaC{O}_{3})}$>Ksp(BaSO4 ),则Na2SO4浓度至少为$\frac{1.1×1{0}^{-10}}{\sqrt{2.5×1{0}^{-9}}}$=2.2×10-6 mol•L,故C正确;
D.当两种沉淀共存时,$\frac{c(S{{O}_{4}}^{2-})}{c(C{{O}_{3}}^{2-})}$=$\frac{Ksp(BaS{O}_{4})}{Ksp(BaC{O}_{3})}$=$\frac{1.1×1{0}^{-10}}{2.5×1{0}^{-9}}$=4.4×10-2,故D错误;
故选C.
点评 本题考查难溶电解质的溶解平衡,为高频考点,把握沉淀的生成、转化及Ksp计算为解答的关键,侧重分析与应用能力的考查,注意选项CD为解答的难点,题目难度不大.

 天天向上口算本系列答案
天天向上口算本系列答案| A. | 氧气 | B. | 氯化氢气体 | C. | 氢气 | D. | 一氧化碳气体 |
| A. | 单质的沸点:B>X | |
| B. | B、X、Y的原子半径大小顺序为:X>Y>B | |
| C. | A的最高价氧化物对应的水化物的酸性强于Y的 | |
| D. | B分别与X、Y形成的化合物中化学键类型相同 |
| A. | 100g质量分数为46%的乙醇溶液中所含的氢原子数为12NA | |
| B. | pH=1的硫酸溶液中含有的SO42-数目为0.05NA | |
| C. | 向1L0.3mol•L-1NaOH溶液中通入0.2molCO2,溶液中CO32-和HCO3-的数目均为0.1NA | |
| D. | 0.2molNH3与0.3molO2在催化剂的作用下加热充分反应,所得NO的分子数为0.2NA |
 某温度下,等体积、c(H+)相同的盐酸和醋酸溶液分别加水稀释,溶液中的c(H+)随溶液体积变化的曲线如图所示.据图判断下列说法正确的是( )
某温度下,等体积、c(H+)相同的盐酸和醋酸溶液分别加水稀释,溶液中的c(H+)随溶液体积变化的曲线如图所示.据图判断下列说法正确的是( )| A. | 曲线Ⅱ表示的是盐酸的变化曲线 | |
| B. | b点溶液的导电性比c点溶液的导电性强 | |
| C. | 取等体积的a点、b点对应的溶液,消耗的NaOH的量相同 | |
| D. | b点酸的总浓度大于a点酸的总浓度 |
| A. | H2SO4 | B. | NaOH | C. | Na2SO4 | D. | CuCl2 |
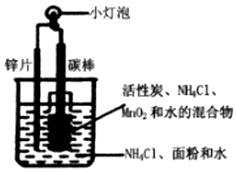 干电池模拟实验装置如图.下列说法不正确的是( )
干电池模拟实验装置如图.下列说法不正确的是( )| A. | 碳棒作正极,锌片作负极 | |
| B. | 电流方向从碳棒流向锌片,电子则相反 | |
| C. | NH4Cl是电解质,在锌片逐渐消耗过程中 MnO2不断被还原 | |
| D. | 该电池是二次电池,该废旧电池中锌可回收 |
| A. | c(Na+)=0.1 mo1•L-1 | B. | c(CO32-)>c(OH-) | ||
| C. | c(HCO3-)>c(CO32-) | D. | c(OH-)>c(H+) |
| 选项 | 实验操作与现象 | 结论 |
| A | 将Fe(NO3)2溶于稀H2SO4后,滴加KSCN溶液, 溶液变成红色 | Fe(NO3)2中一定含Fe3+ |
| B | 从煤油中取出一小块钠,用滤纸擦净表面的煤油, 放入无水乙醇中,产生气泡 | Na能置换出醇烃基中的氢 |
| C | 将某气体通入品红溶液,溶液褪色 | 气体一定是SO2 |
| D | 向NaAlO2溶液中滴入NaHCO3溶液,产生白色沉淀 | AlO2-结合H+的能力比CO32-强 |
| A. | A | B. | B | C. | C | D. | D |