题目内容
能正确表示下列化学反应的离子方程式的是( )
| A、铁与稀盐酸反应:2Fe+6H+=2Fe3++3H2↑ |
| B、铝粉投入到NaOH溶液中:Al+2OH-═AlO2-+H2↑ |
| C、氯化铁溶液中加入铁粉:2Fe3++Fe═3Fe2+ |
| D、AlCl3溶液中加入足量的氨水:Al3++3OH-═Al(OH)3↓ |
考点:离子方程式的书写
专题:离子反应专题
分析:A.不符合反应的客观事实;
B.电荷不守恒;
C.三价铁离子氧化 铁生成二价铁离子;
D.氯化铝与氨水反应生成氯化铵和氢氧化铝.
B.电荷不守恒;
C.三价铁离子氧化 铁生成二价铁离子;
D.氯化铝与氨水反应生成氯化铵和氢氧化铝.
解答:
解:A.铁与稀盐酸反应生成氢气和氯化亚铁,离子方程式:Fe+2H+=Fe2++H2↑,故A错误;
B.铝粉投入到NaOH溶液中,离子方程式:2Al+2H2O+2OH-═2AlO2-+3H2↑,故B错误;
C.氯化铁溶液中加入铁粉,离子方程:2Fe3++Fe═3Fe2+,故C正确;
D.AlCl3溶液中加入足量的氨水:Al3++3NH3?H2O═Al(OH)3↓+3NH4+,故D错误;
故选:C.
B.铝粉投入到NaOH溶液中,离子方程式:2Al+2H2O+2OH-═2AlO2-+3H2↑,故B错误;
C.氯化铁溶液中加入铁粉,离子方程:2Fe3++Fe═3Fe2+,故C正确;
D.AlCl3溶液中加入足量的氨水:Al3++3NH3?H2O═Al(OH)3↓+3NH4+,故D错误;
故选:C.
点评:本题考查了离子方程式书写,明确反应的实质是解题关键,注意离子方程式应符合反应的客观规律、遵循电荷守恒、原子个数守恒规律.

练习册系列答案
相关题目
关于铅蓄电池的说法正确的是( )
| A、在放电时,电池中硫酸的浓度不断变小 |
| B、在放电时,正极发生的反应是Pb(s)+SO42-(aq)=PbSO4(s)+2e- |
| C、在充电时,电池中阴极质量不断变小 |
| D、在充电时,阳极发生的反应是 PbSO4(s)+2e-=Pb(s)+SO42-(aq) |
常温下,分别将四块形状相同,质量均为7g的铁片同时放入下列四种溶液中,产生H2的速率最快的是( )
| A、500mL2mol?L-1稀硫酸 |
| B、150mL5mol?L-1稍酸 |
| C、50mL3mol?L-1盐酸 |
| D、500mL2mol?L-1稀硫酸和少量硫酸铜 |
下列说法正确的是( )
| A、干冰升华要吸收大量的热,这就是化学反应中的吸热反应 |
| B、凡是在加热或点燃条件下进行的反应都是吸热反应 |
| C、人们用氢氧焰焊接或切割金属,主要是利用了氢气和氧气化合时所放出的能量 |
| D、明矾有净水作用,所以用明矾处理硬水,可以使硬水软化 |
下列说法正确的是( )
| A、摩尔是一个基本物理量 |
| B、CH4的摩尔质量为16g |
| C、在同温同压下,相同体积的任何气体单质所含分子数相同 |
| D、500mL,1mol/L MgCl2溶液中含有Cl-数目为0.5NA |
按“单质、氧化物、盐”的顺序排列的一组物质是( )
| A、SO2 S Na2SO4 |
| B、Si SiO2 Na2SiO3 |
| C、CO2 Na2CO3 C |
| D、Al Al2O3 Al(OH)3 |
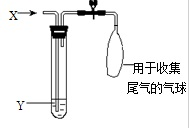 如图是检验气体性质的一种实验装置,请回答:
如图是检验气体性质的一种实验装置,请回答: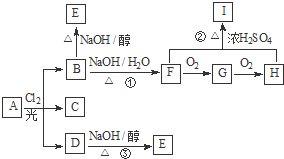 【化学--选修5有机化学基础】
【化学--选修5有机化学基础】