题目内容
9.图1为长式周期表的一部分,其中的编号代表对应的元素.
(1)写出元素⑤的原子轨道表示式
 .
.(2)写出元素⑨的基态原子的价电子排布式3d84s2.
(3)表中属于ds区的元素是⑩(填编号)
(4)元素⑩形成的单质是由金属键形成的晶体,该晶体采取的堆积方式是面心立方最密堆积,晶体中⑩元素原子的配位数是12.
(5)元素④、⑤、⑥、⑦的离子半径由小到大的顺序是Al3+<Mg2+<Cl-<S2-(用离子符号表示)
(6)写出元素①和元素⑧形成化合物的电子式K+[:H]-.
(7)元素⑨与⑩的第二电离能分别为:I⑨=1753kJ/mo1,I⑩=1959kJ/mo1,第二电离能I⑨<I⑩的原因是铜失去的是全充满的3d10电子,镍失去的是4s1电子.
(8)科学家发现,②、④、⑨三种元素的原子形成的晶体具有超导性,其晶胞的结构特点如图2所示(图中②、④、⑨分别位于晶胞的体心、顶点、面心),则该化合物的化学式为MgNi3C(用对应的元素符号表示).
分析 由元素在周期表中的位置可知,①为H,②为C,③为O,④为Mg,⑤为Al,⑥为S,⑦为Cl,⑧为Ca,⑨为Ni,⑩为Cu;
(1)元素⑤为Al,核电荷数为13,其基态原子电子排布式为1s22s22p63s23p1,再画出电子轨道表达式;
(2)Ni元素原子核外电子数为28,先结合能量最低原理书写核外电子排布式,再写出价电子排布式;
(3)以上元素只有Cu为ds区元素;
(4)Cu为金属元素,其单质晶体为金属晶体,含有金属键;根据晶胞类型判断原子的堆积方式;根据晶胞类型判断配位数;
(5)离子的电子层越多,半径越大,具有相同电子层结构的离子,原子序数大的离子半径小;
(6)钾是活泼金属元素,而氢为非金属元素,则KH是离子化合物,根据电子式的书写来回答;
(7)Cu+的外围电子排布为3d10,Ni+的外围电子排布为3d84s1,Cu+的核外电子排布更稳定;
(8)根据均摊法计算晶胞中Mg、Ni、C原子数目,确定化学式.
解答 解:由元素在周期表中的位置可知,①为H,②为C,③为O,④为Mg,⑤为Al,⑥为S,⑦为Cl,⑧为Ca,⑨为Ni,⑩为Cu;
(1)元素⑤为Al,Al原子的质子数为13,其基态时的轨道表示式为 ,故答案为:
,故答案为: ;
;
(2)Ni元素原子核外电子数为28,核外电子排布式为:1s22s22p63s23p63d84s2,则价电子排布式为3d84s2,故答案为:3d84s2;
(3)元素周期表中位于ds区的元素为第ⅠB、ⅡB族,以上元素只有Cu为ds区元素,故答案为:⑩;
(4)晶体Cu中含有的化学键为金属键;该晶胞类型为面心立方晶胞,则其堆积类型为面心立方最密堆积;根据晶胞结构,铜原子位于顶点和面心,一个晶胞中距离顶点铜原子最近且距离相等的、位于面心的铜原子数为3,由于该铜原子被8个晶胞共有,每个面心铜原子计算了两次,则顶点铜原子配位数为:3×8÷2=12,即配位数为12,
故答案为:金属;面心立方最密堆积;12;
(5)离子的电子层越多,半径越大,具有相同电子层结构的离子,原子序数大的离子半径小,所以离子半径由小到大的顺序为Al3+<Mg2+<Cl-<S2-,
故答案为:Al3+<Mg2+<Cl-<S2-;
(6)K和H形成的化合物氯化钙是离子化合物,电子式为K+[:H]-,故答案为:K+[:H]-;
(7)Cu+的外围电子排布为3d10,呈半充满状态,比较稳定,Ni+的外围电子排布为3d84s1,Cu+的核外电子排布更稳定,失去第二个电子更难,元素铜的第二电离能高于镍的,
故答案为:铜失去的是全充满的3d10电子,镍失去的是4s1电子;
(8)晶胞中Mg处于顶点,C处于体心,Ni处于面心,则晶胞中Ni原子数目为6×$\frac{1}{2}$=3、C原子数目为1、Mg原子数目为8×$\frac{1}{8}$=1,则其化学式为MgNi3C,故答案为:MgNi3C.
点评 本题考查位置、结构、性质的应用,涉及元素周期表中元素的分区、元素周期表中元素的位置、电子排布式、分子构型、非金属性比较等,综合性较强,题目难度中等.

| A. | 在配制一定物质的量浓度溶液的定容步骤时,俯视凹液面,所配溶液浓度偏高 | |
| B. | 向盛有5mL 4%和5mL 12%的过氧化氢溶液中分别加入几滴等浓度的氯化铁溶液,后者产生气泡速率快 | |
| C. | KI溶液中加少量新制的氯水,再加少量苯充分振荡后静置,上层为紫红色 | |
| D. | 用pH试纸测溶液的pH和用红色石蕊试纸检测气体时均不需要润湿 |
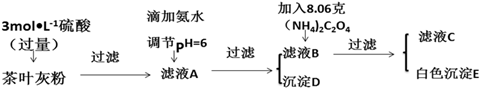
请回答下列有关问题:
(1)文献资料显示,某些金属离子的氢氧化物完全沉淀的pH为:
| 离子 | Ca2+ | Fe3+ |
| 完全沉淀时的pH | 13 | 4.1 |
(2)写出从滤液A→沉淀D的离子反应方程式Fe3++3NH3•H2O=Fe(OH)3↓+3NH4+.
(3)为保证实验精确度,沉淀D及E需要分别洗涤,并将洗涤液转移回母液中,判断D已经沉淀完全方法是静置,向上层清液中继续滴加氨水若无红褐色沉淀生成则说明D已沉淀完全,否则未沉淀完全.
(4)用KMnO4标准溶液滴定C溶液时所发生的反应为:5C2O42-+2MnO4-+16H+═10CO2↑+2Mn2++8H2O.
现将滤液C稀释至500mL,再取其中的25.00mL溶液,用硫酸酸化后,用0.1000mol•L-1的KMnO4标准溶液滴定,终点时消耗KMnO4溶液10.00mL.

①此步操作过程中KMnO4标准溶液应装在图2中哪个仪器中(填写字母)B.
②滴定到终点,现象无色变为浅红色,静置后,如图3方法读取KMnO4标准溶液的刻度数据,则测定的钙元素含量将偏高(填“偏高”“偏低”或“无影响”).
(5)原茶叶中钙元素的质量分数为0.3%.
 利用天然气可制得以H2、CO等为主要组成的工业原料合成气,反应为CH4(g)+H2O(g)?CO(g)+3H2(g).
利用天然气可制得以H2、CO等为主要组成的工业原料合成气,反应为CH4(g)+H2O(g)?CO(g)+3H2(g). 尿素[CO(NH2)2]是首个由无机物人工合成的有机物.
尿素[CO(NH2)2]是首个由无机物人工合成的有机物. +CH2═CH-M$→_{碱}^{Pb}$
+CH2═CH-M$→_{碱}^{Pb}$ =CH-M+HX(X为卤原子,M为烃基或含酯基的取代基等),由有机物A合成G(香豆素)的步骤如下:
=CH-M+HX(X为卤原子,M为烃基或含酯基的取代基等),由有机物A合成G(香豆素)的步骤如下: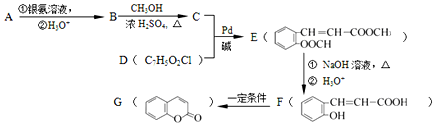
 .
. 中任意2种.
中任意2种. 的路线流程图:
的路线流程图: .
. 如图是金属镁和卤素反应的能量变化图(反应物和产物均为298K时的稳定状态).由图可知Mg与卤素单质的反应均为放热(填“放热”或“吸热”)反应.
如图是金属镁和卤素反应的能量变化图(反应物和产物均为298K时的稳定状态).由图可知Mg与卤素单质的反应均为放热(填“放热”或“吸热”)反应.