题目内容
实验室常用浓盐酸与二氧化锰反应制取少量氯气,反应的化学方程式为:4HCl(浓)+MnO2
MnCl2+2H2O+Cl2↑,取足量12mol?L-1浓盐酸使其与二氧化锰发生反应,产生的氯气在标准状况下的体积为4.48L.计算(写出具体计算过程)
(1)被氧化的HCl的物质的量
(2)参加反应的MnO2的质量.
| ||
(1)被氧化的HCl的物质的量
(2)参加反应的MnO2的质量.
考点:化学方程式的有关计算
专题:
分析:(1)被氧化的HCl生成氯气,根据Cl原子守恒计算被氧化HCl物质的量;
(2)根据方程式MnO2+4HCl(浓)
MnCl2+C12↑+2H2O计算消耗二氧化锰的质量.
(2)根据方程式MnO2+4HCl(浓)
| ||
解答:
解:(1)n(C12)=
=0.2mol,被氧化的HCl生成氯气,根据Cl原子守恒,被氧化HCl物质的量=2n(C12)=2×0.2mol=0.4mol,
答:被氧化的氯化氢的物质的量为0.4mol;
(2)MnO2+4HCI(浓)=MnCl2+C12↑+2H2O
87g 1mol
m 0.2mol
m=
=17.4g,
答:参加反应的MnO2的质量为17.4g.
| 4.48L |
| 22.4L/mol |
答:被氧化的氯化氢的物质的量为0.4mol;
(2)MnO2+4HCI(浓)=MnCl2+C12↑+2H2O
87g 1mol
m 0.2mol
m=
| 87g×0.2mol |
| 1mol |
答:参加反应的MnO2的质量为17.4g.
点评:本题考查化学方程式计算、氧化还原反应计算,难度不大,侧重对基础知识的巩固,注意被氧化氯化氢和氯气的关系.

练习册系列答案
相关题目
下列说法正确的是( )
A、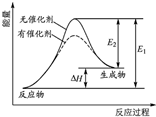 某反应的反应过程中能量变化如图所示,由如图分析可知催化剂不改变反应的焓变 | ||||||||||
| B、常温下Na与足量O2反应生成Na2O,随温度升高生成Na2O的速率逐渐加快 | ||||||||||
C、已知:
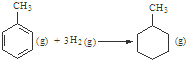 的△H为-384 kJ?mol-1 的△H为-384 kJ?mol-1 | ||||||||||
| D、常温下在0.10 mol?L-1的氨水中加入少量NH4Cl晶体,NH3?H2O的电离程度和溶液的pH均减小 |
下列表示对应化学反应的离子方程式错误的是( )
| A、向NH4HSO4的稀溶液中逐滴加入Ba(OH)2溶液至刚好沉淀完全:NH4++H++SO42-+Ba2++2OH-=NH3?H2O+BaSO4↓+H2O |
| B、酸性高锰酸钾溶液与H2O2溶液混合:2MnO4-+3H2O2+6H+=2Mn2++6H2O+O2↑ |
| C、向碳酸氢钙溶液中滴入少量澄清石灰水:Ca2++HCO3-+OH-=CaCO3↓+H2O |
| D、向氨水中通入少量的二氧化硫气体:2NH3?H2O+SO2=2NH4++SO32-+H2O |
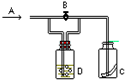 如图所示,A处通入潮湿的Cl2,关闭B阀时,C处干燥的红色布条无变化; 打开B阀时,C处干燥的红色布条褪色,则D中的溶液是( )
如图所示,A处通入潮湿的Cl2,关闭B阀时,C处干燥的红色布条无变化; 打开B阀时,C处干燥的红色布条褪色,则D中的溶液是( )| A、浓盐酸 |
| B、H2O |
| C、NaOH溶液 |
| D、饱和食盐水 |