题目内容
15.有以下物质:①Mg②Al③Cu ④稀硫酸⑤浓硫酸⑥NaOH溶液(1)写出①与④反应的离子方程式Mg+2H+═Mg2++H2↑
(2)既能跟④又能跟⑥反应的是②(填序号),写出它与⑥反应的化学方程2Al+2NaOH+2H2O═2NaAlO2+3H2↑
(3 )写出③与⑤反应的化学方程式Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O,该反应中⑤体现的性质氧化性和酸性
足量的铜片与1OOmoL,8mol/L的浓H2S04充分反应,如果该反应过程中转移了
0.2mol电子,生成的CuS04的质量为16克,生成的A气体在标准状况下体积为2.24升(假设气体全部逸出)
分析 (1)镁与稀硫酸发生置换反应,实质是与氢离子之间发生氧化还原反应;
(2)既能跟酸又能跟碱反应的是铝;
(3)铜与浓硫酸反应生成硫酸铜、水和二氧化硫,浓硫酸中的+6价的硫全部转化为+4价,浓硫酸反应生成硫酸铜变化中硫元素化合价不变表现酸性,足量的铜片与1OOmL,8mol/L的浓H2S04充分反应,如果该反应过程中转移了0.2mol电子,结合化学方程式和电子转移守恒计算生成硫酸铜和二氧化硫气体体积;
解答 解:(1)镁与稀硫酸发生置换反应,实质是与氢离子之间发生氧化还原反应,所以离子反应方程式为:Mg+2H+═Mg2++H2↑,
故答案为:Mg+2H+═Mg2++H2↑;
(2)既能跟酸又能跟碱反应的是铝,铝与氢氧仳钠反应生成偏铝酸钠,化学方程式为:2Al+2NaOH+2H2O═2NaAlO2+3H2↑,
故答案为:②;2Al+2NaOH+2H2O═2NaAlO2+3H2↑;
(3)铜与浓硫酸反应生成硫酸铜、水和二氧化硫,方程式为:Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O,浓硫酸中的+6价的硫全部转化为+4价,所以硫酸显氧化性,硫酸生成硫酸铜中硫元素化合价不变显示了酸性,足量的铜片与1OOmL,8mol/L的浓H2S04充分反应,化学方程式中生成1mol二氧化硫电子转移2mol,如果该反应过程中转移了0.2mol电子,生成二氧化硫0.1mol,生成硫酸铜0.1mol,生成硫酸铜质量=0.1mol×160g/mol=16g,生成二氧化硫气体体积标准状况下=0.1mol×22.4L/mol=2.24L,
故答案为:Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O; 氧化性和酸性;16;2.24;
点评 本题考查离子方程式和化学方程式的书写、氧化还原反应中氧化剂和还原剂的分析、氧化还原反应电子转移计算,注意浓硫酸的作用判断,题目难度中等.

 阅读快车系列答案
阅读快车系列答案| A. | Cu2+、Na+、NO3-、SO42- | B. | Ba2+、NH4+、Cl-、SO42- | ||
| C. | Na+、K+、ClO-、SO42- | D. | H+、Na+、I-、NO3- |
| A. | 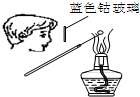 检验Na2CO3中的Na+ | B. | 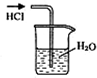 吸收HCl | ||
| C. | 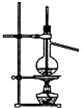 石油的蒸馏 | D. | 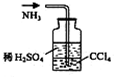 吸收NH3 |
| A. | 道尔顿发现原子--“空心球”模型 | |
| B. | 汤姆逊发现电子--“葡萄干布丁”模型 | |
| C. | 卢瑟福进行α粒子散射实验--“核式”模型 | |
| D. | 玻尔解释氢原子光谱--“电子分层排布”模型 |
 常温下,将氯气缓慢通入水中至饱和,再向其中缓慢滴加0.1 mol•L-1 NaOH溶液,整个过程中pH变化如图所示,下列有关叙述不正确的是( )
常温下,将氯气缓慢通入水中至饱和,再向其中缓慢滴加0.1 mol•L-1 NaOH溶液,整个过程中pH变化如图所示,下列有关叙述不正确的是( )| A. | a点时,某同学用玻璃棒蘸取溶液滴在蓝色的石蕊试纸上,试纸最终变红 | |
| B. | a-b段,溶液中$\frac{c({H}^{+})}{c(Cl{O}^{-})}$增大 | |
| C. | b点对应溶液中:c(Cl-)>c(H+)>c(HClO)>c(ClO-)>c(OH-) | |
| D. | c点对应溶液中:c(Na+)=2c(ClO-)+c(HClO) |
| A. | ①减小,②不变,③减小 | B. | ①增大,②不变,③减小 | ||
| C. | ①增大,②不变,③增大 | D. | ①减小,②不变,③增大 |
| 化学式 | CH3COOH | H2CO3 | HClO | |
| 电离平衡常数 | Ka=1.8×10-5 | Ka1=4.3×10-7 | Ka2=5.6×10-11 | Ka=3.0×10-8 |
| A. | CH3COONa | B. | Na2CO3 | C. | NaClO | D. | NaHCO3 |