题目内容
16.在滴有石蕊试液的碳酸钠溶液中,加入过量盐酸,加盐酸前后溶液的颜色依次为( )| A. | 紫色、红色 | B. | 红色、蓝色 | C. | 蓝色、红色 | D. | 红色、无色 |
分析 碳酸钠溶液水解显碱性,加入过量盐酸生成氯化钠,且溶液在含过量的盐酸,结合指示剂的变色来解答.
解答 解:碳酸钠溶液水解显碱性,加盐酸前,滴有石蕊试液的碳酸钠溶液为蓝色;
加入过量盐酸生成氯化钠,且溶液在含过量的盐酸,则盐酸遇石蕊变红,
故选C.
点评 本题考查物质的性质及指示剂的变色,为高频考点,把握发生的反应及溶液酸碱性判断为解答的关键,侧重分析与应用能力的考查,题目难度不大.

练习册系列答案
相关题目
16.下列说法正确的是( )
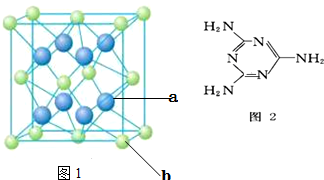
| A. | 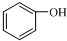 和 和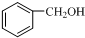 互为同系物 互为同系物 | |
| B. | 教材中做石蜡油分解实验和石油蒸馏实验都会用到碎瓷片,其作用是相同的 | |
| C. | 某烃的结构用键线式表示为 ,该烃与Br2按物质的量之比1:1加成时所得产物有5种 ,该烃与Br2按物质的量之比1:1加成时所得产物有5种 | |
| D. | 105℃,1.01×105Pa时,aL某气态烃在bL氧气(足量)中完全燃烧,将所得混合气体通过浓硫酸剩余气体cL,则烃燃烧生成的水蒸气的体积就是(a+b-c)L(气体体积在相同条件下测定) |
4.已知反应:2NO2(红棕色)?N2O4(无色)△H<0.将一定量的NO2充入注射器中后封口,如图是在拉伸和压缩注射器的过程中气体透光率随时间的变化(气体颜色越深,透光率越小).下列说法正确的是( )
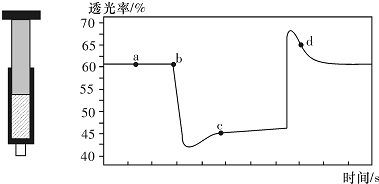

| A. | b点的操作是拉伸注射器 | |
| B. | d点:v(正)>v(逆) | |
| C. | c点与a点相比,c(NO2)增大,c(N2O4)减小 | |
| D. | 若不忽略体系温度变化,且没有能量损失,则T(b)<T(c) |
1.下列说法不正确的是( )
| A. | 含SO2的烟气可用石灰乳吸收后再排放,以减少对空气污染 | |
| B. | 可用丁达尔效应区别胶体和溶液 | |
| C. | 绿色化学的核心是对环境产生的污染进行治理 | |
| D. | PM2.5由于颗粒小,在空气中存在时间长,对人体健康危害大 |
6.一定温度下,在三个体积均为1.0L恒容密闭容器中发生反应:
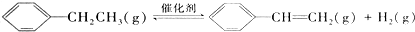
下列说法正确的是( )
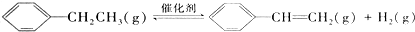
下列说法正确的是( )
| 窗口编号 | 温度(℃) | 起始物质的量(mol) | 平衡物质的量(mol) | |
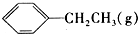 | 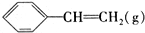 | H2(g) | ||
| 1 | 380 | 0.10 | 0.60 | 0.060 |
| 2 | 380 | 0.20 | ||
| 3 | 230 | 0.10 | 0.050 | 0.050 |
| A. | 该反应的正反应为放热反应 | |
| B. | 达到平衡时,容器I中的H2体积分数比容器Ⅱ中的小 | |
| C. | 容器I中反应达到平衡所需的时间比容器Ⅲ中的长 | |
| D. | 若起始时向容器Ⅲ中充入0.10mol (g)、0.10mol (g)、0.10mol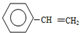 (g)和0.10mol H2,则反应向逆反应方向进行 (g)和0.10mol H2,则反应向逆反应方向进行 |
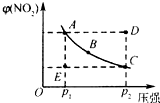 对于N2O4(g)?2NO2(g)在温度一定时,平衡体系中NO2的体积分数V(NO2)%随压强的变化情况如图所示(实线上的任何一点为对应压强下的平衡点).
对于N2O4(g)?2NO2(g)在温度一定时,平衡体系中NO2的体积分数V(NO2)%随压强的变化情况如图所示(实线上的任何一点为对应压强下的平衡点).
 ,P元素属于ds区元素.
,P元素属于ds区元素.