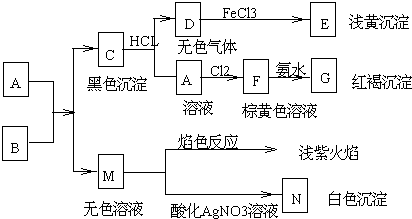
题目内容
5.X、Y、Z、M、N、Q P为元素周期表前四周期的7种元素.其中,X原子核外的M层中只有两对成对电子,Y原子核外的L层电子数是K层的两倍,Z是地壳内含量最高的元素,M的内层电子数是最外层电子数的9倍,N的原子序数比M小1,Q在元素周期表的各元素中电负性最大.P元素的第三电子层处于全充满状态,第四电子层只有一个电子请回答下列问题:(1)X元素在周期表中的位置是第三周期ⅥA族,它的外围电子的电子排布图为
 ,P元素属于ds区元素.
,P元素属于ds区元素.(2)XZ2分子的空间构型是V型,YZ2分子中Y的杂化轨道类型为sp杂化,相同条件下两者在水中的溶解度较大的是SO2(写分子式),理由是SO2;SO2为极性分子,CO2为非极性分子,H2O为极性溶剂,极性分子易溶于极性溶剂,故SO2的溶解度较大.
(3)含有元素N的盐的焰色反应为紫 色,许多金属盐都可以发生焰色反应,其原是电子由较高能级跃迁到较低能级时,以光的形式释放能量
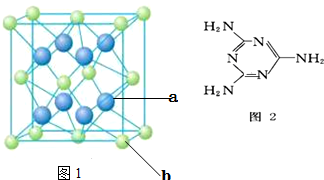
(4)元素M与元素Q形成晶体结构如图1所示,设其晶胞边长为a pm,该化合物的摩尔质量为Dg/mol.求该晶胞密度的计算式为$\frac{4×1{0}^{30}×D}{{a}^{3}×{N}_{A}}$g/cm3
(5)三聚氰胺是一种含氮化合物,其结构简式如图2所示. 三聚氰胺分子中氮原子轨道杂化类型是sp2、sp3,1mol三聚氰胺分子中 σ键的数目为15NA.
分析 X、Y、Z、M、N、Q、P为元素周期表前四周期的7种元素,X原子核外的M层中只有两对成对电子,核外电子排布应为1s22s22p63s23p4,X为S元素;Y原子核外的L层电子数是K层的两倍,Y有2个电子层,最外层电子数为4,故Y为C元素;Z是地壳内含量最高的元素,为O元素;M的内层电子数是最外层电子数的9倍,M只能处于第四周期,最外层电子数只能为2,内层电子总数为18,核外电子总数为20,故M为Ca元素;N的原子序数比M小1,则N为K元素;Q在元素周期表的各元素中电负性最大,Q为F元素;P元素的第三电子层处于全充满状态,第四电子层只有一个电子,原子核外电子数=2+8+18+1=29,则P为Cu元素,据此解答.
解答 解:X、Y、Z、M、N、Q、P为元素周期表前四周期的7种元素,X原子核外的M层中只有两对成对电子,核外电子排布应为1s22s22p63s23p4,X为S元素;Y原子核外的L层电子数是K层的两倍,Y有2个电子层,最外层电子数为4,故Y为C元素;Z是地壳内含量最高的元素,为O元素;M的内层电子数是最外层电子数的9倍,M只能处于第四周期,最外层电子数只能为2,内层电子总数为18,核外电子总数为20,故M为Ca元素;N的原子序数比M小1,则N为K元素;Q在元素周期表的各元素中电负性最大,Q为F元素;P元素的第三电子层处于全充满状态,第四电子层只有一个电子,原子核外电子数=2+8+18+1=29,则P为Cu元素,
(1)X为S元素,元素在周期表中的位置是:第三周期ⅥA族,外围电子排布为3s23p4,它的外围电子的电子排布图为 ,P元素为Cu,属于ds区元素,
,P元素为Cu,属于ds区元素,
故答案为:第三周期ⅥA族; ;ds;
;ds;
(2)SO2分子中S原子价层电子对数=2+$\frac{6-2×2}{2}$=3,S原子含有1对孤电子对,故其立体结构是V型,CO2分子C原子呈2个σ键、没有孤电子对,C的杂化轨道类型为sp杂化,SO2为极性分子,CO2为非极性分子,H2O为极性溶剂,极性分子易溶于极性溶剂,故SO2的溶解度较大,
故答案为:V型;sp杂化;SO2;SO2为极性分子,CO2为非极性分子,H2O为极性溶剂,极性分子易溶于极性溶剂,故SO2的溶解度较大;
(3)含有K元素的盐的焰色反应为紫色,许多金属盐都可以发生焰色反应,其原因是电子由较高能级跃迁到较低能级时,以光的形式释放能量,
故答案为:紫;电子由较高能级跃迁到较低能级时,以光的形式释放能量;
(4)元素Ca与元素F形成晶体,晶胞中蓝色球数目=8×$\frac{1}{8}$+6×$\frac{1}{2}$=4、蓝色球为8个,故化学式为CaF2,该化合物的摩尔质量为D g/mol,晶胞质量=4×$\frac{D}{{N}_{A}}$g,晶胞边长为a pm,则晶胞体积=(a×10-10 cm)3=a3××10-30 cm3,则晶胞密度=$\frac{4×\frac{D}{{N}_{A}}}{{a}^{3}×1{0}^{-30}c{m}^{3}}$=$\frac{4×1{0}^{30}×D}{{a}^{3}×{N}_{A}}$g/cm3,
故答案为:$\frac{4×1{0}^{30}×D}{{a}^{3}×{N}_{A}}$;
(5)三聚氰胺分子中处于环上的N原子成2个σ键,有1对孤电子对,采取sp2杂化,氨基中N原子成3个σ键,含有1对孤电子对,N原子采取sp3杂化,单键为σ键,双键含有1个σ键、1个π键,故1个三聚氰胺分子含有15个σ键,则1mol三聚氰胺分子中σ键的数目为15NA,
故答案为:sp2、sp3;15NA.
点评 本题是对物质结构的考查,涉及核外电子的排布、化学键、杂化方式与空间构型、分子结构与性质、晶胞计算等,(4)中注意利用均摊法计算晶胞的质量,难度中等.

 如图是常温下等物质的量浓度的部分短周期元素最高价氧化物对应水化物的稀溶液的pH与原子序数的关系图,Z的氧化物是两性氧化物.下列说法正确的是( )
如图是常温下等物质的量浓度的部分短周期元素最高价氧化物对应水化物的稀溶液的pH与原子序数的关系图,Z的氧化物是两性氧化物.下列说法正确的是( )| A. | E、X、L三种元素的非金属性强弱关系为E<L<X | |
| B. | 同浓度的W、R两种元素的最高价氧化物对应水化物的溶液中,pH后者更小 | |
| C. | 元素Z、J对应的单质均能与Y的最高价氧化物对应的水化物反应生成H2,故它们的性质相同 | |
| D. | 元素X、Y、W形成的某化合物的溶液能与W的最高价氧化物对应的水化物反应生成气体 |
| A. | 紫色、红色 | B. | 红色、蓝色 | C. | 蓝色、红色 | D. | 红色、无色 |
| A. | 1.5 mol/L | B. | 2.0mol/L | C. | 0.18 mol/L | D. | 0.24mol/L |
| A. | 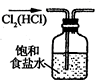 除去Cl2中HCl | B. | 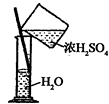 稀释浓H2SO4 | C. | 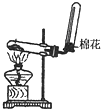 制取氧气 | D. | 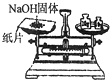 称取NaOH |
| A. | $\frac{125a}{288V}$mol•L-1 | B. | $\frac{125a}{72V}$mol•L-1 | ||
| C. | $\frac{a}{2304V}$mol•L-1 | D. | 以上答案均不正确 |
| A. | Cl2 | B. | SO2 | C. | CO | D. | O2 |