题目内容
15.硫代硫酸钠(Na2S2O3)可作为还原剂,已知25.0mL0.0100mol/LNa2S2O3溶液恰好把22.4mL(标准状况下)Cl2完全转化为Cl-离子,则S2O32-将转化成( )| A. | S2- | B. | S | C. | SO42- | D. | SO32- |
分析 Cl2完全转化为Cl-,根据电子转移守恒可知,Na2S2O3被氧化,S元素化合价升高,令氧化产物中S元素的化合价为m,根据电子转移守恒列方程计算解答.
解答 解:Cl2完全转化为Cl-,根据电子转移守恒可知,Na2S2O3被氧化,S元素化合价升高,令氧化产物中S元素的化合价为m,根据电子转移守恒得:$\frac{0.224L}{22.4L/mol}$×2×1=0.025 L×0.100 mol/L×2×(m-2)
解得m=6,故得到SO42-,
故选C.
点评 本题考查氧化还原反应有关计算,注意利用电子转移守恒计算,难度中等.

练习册系列答案
相关题目
5.下列实验操作中错误的是( )
| A. | 由于碘在酒精中的溶解度大,所以可用酒精把碘水中的碘萃取出来 | |
| B. | 蒸馏操作时,应使温度计水银球靠近蒸馏烧瓶的支管口处 | |
| C. | 使用容量瓶前检查它是否漏水 | |
| D. | 蒸发操作时,不能使混合物中的水分完全蒸干后才停止加热 |
6.X、Y、Z、W是原子序数依次增大的四种短周期主族元素,已知Z的最高正价与最低负价的代数和为4,Y能形成两种常见的液体二元化合物M、Q,其中M是生物生存必需的物质,X能形成多种单质,其中有两种单质硬度差异极大,下列说法中正确的是( )
| A. | 元素X只能形成一种氢化物 | |
| B. | 原子半径的大小顺序:r(W)>r(Z)>r(X)>r(Y) | |
| C. | 化合物Q中存在两种类型的共价键 | |
| D. | X与Z形成的化合物在熔融状态下能导电 |
20.硫酸亚锡(SnSO4)是一种重要的能溶于水的硫酸盐,广泛应用于镀锡工业.SnSO4的实验室制备设计路线如图:下列有关说法正确的是( )
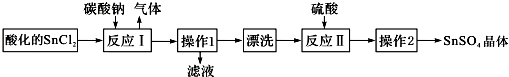

| A. | SnCl2酸化是为了防止溶解时发生水解 | |
| B. | 反应I中发生的离子反应为:CO32-+2H+═CO2↑+H2O | |
| C. | 漂洗时,将固体置于烧杯中,加蒸馏水洗涤过滤2-3次 | |
| D. | 操作1为过滤,操作2为盐析 |
7.用NA表示阿伏加德罗常数的值,下列有关说法正确的是( )
| A. | 78g过氧化钠晶体中,含3NA个离子 | |
| B. | 常温常压下,22.4L氦气含有NA个氦原子 | |
| C. | 在O2参与的反应中,1 mol O2作氧化剂时得到的电子数一定是4NA | |
| D. | 常温下16g O2与O3的混合气体中含氧原子数为NA |
4.物质的量浓度相同的下列溶液中:①NH4Cl ②NH3•H2O ③(NH4)2SO4 ④NH4HSO4⑤NH4HCO3 c(NH4+)由大到小的顺序是( )
| A. | ⑤②③①④ | B. | ④①③②⑤ | C. | ③⑤④①② | D. | ③④①⑤② |
5.合物储热材料,无论从经济效益、资源综合利用还是从环境保护角度看都具有重要意义.以下是石膏转化为硫酸钾和氯化钙的工艺流程示意图.
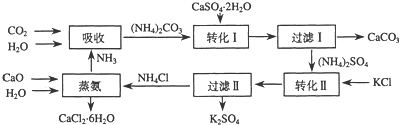
(1)本工艺中所用的原料除CaSO4•2H2O、KCl外,还需要CaCO3(或CaO)、NH3、H2O等原料
(2)写出石膏悬浊液中加入碳酸铵溶液后发生反应的离子方程式:CaSO4+CO32-=CaCO3+SO42-
(3)过滤Ⅰ操作所得固体中,除CaCO3外还含有CaSO4(填化学式)等物质,该固体可用作生产水泥的原料.
(4)过滤Ⅰ操作所得滤液是(NH4)2SO4溶液.检验滤液中含有CO32-的方法是:取少量溶液,滴加稀盐酸,若有气泡产生则还含有CO32-,反之则不含有CO32-.
(5)已知不同温度下K2SO4在100g水中达到饱和时溶解的量如下表:
60℃时K2SO4的饱和溶液591g冷却到0℃,可析出K2SO4晶体54g
(6)氯化钙结晶水合物(CaCl2•6H2O)是目前常用的无机储热材料,选择的依据是ad
A、熔点较低(29℃熔化) b、能导电 c、能制冷 d、无毒
(7)上述工艺流程中体现绿色化学理念的是:碳酸钙用于制水泥原料、硫酸钙和氯化钾转化为硫酸钾和氯化钙、氨在工艺中循环使用等(原子利用率高,没有有害物质排放到环境中).

(1)本工艺中所用的原料除CaSO4•2H2O、KCl外,还需要CaCO3(或CaO)、NH3、H2O等原料
(2)写出石膏悬浊液中加入碳酸铵溶液后发生反应的离子方程式:CaSO4+CO32-=CaCO3+SO42-
(3)过滤Ⅰ操作所得固体中,除CaCO3外还含有CaSO4(填化学式)等物质,该固体可用作生产水泥的原料.
(4)过滤Ⅰ操作所得滤液是(NH4)2SO4溶液.检验滤液中含有CO32-的方法是:取少量溶液,滴加稀盐酸,若有气泡产生则还含有CO32-,反之则不含有CO32-.
(5)已知不同温度下K2SO4在100g水中达到饱和时溶解的量如下表:
| 温度(℃) | 0 | 20 | 60 |
| K2SO4溶解的量(g) | 7.4 | 11.1 | 18.2 |
(6)氯化钙结晶水合物(CaCl2•6H2O)是目前常用的无机储热材料,选择的依据是ad
A、熔点较低(29℃熔化) b、能导电 c、能制冷 d、无毒
(7)上述工艺流程中体现绿色化学理念的是:碳酸钙用于制水泥原料、硫酸钙和氯化钾转化为硫酸钾和氯化钙、氨在工艺中循环使用等(原子利用率高,没有有害物质排放到环境中).
 ,AE3的分子立体构型为三角锥形;AE3分子在潮湿空气中能水解生成一种常用的漂白剂X和一种能使紫色石蕊变蓝色的气体Y,完成反应方程式:NCl3+3H2O=3HClO+NH3.
,AE3的分子立体构型为三角锥形;AE3分子在潮湿空气中能水解生成一种常用的漂白剂X和一种能使紫色石蕊变蓝色的气体Y,完成反应方程式:NCl3+3H2O=3HClO+NH3.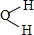 .
.