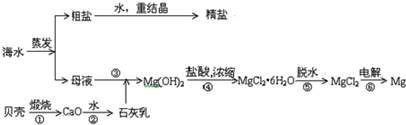
题目内容
16.填写下列材料主要化学成分的化学式.(1)刚玉:Al2O3;
(2)大理石、石灰石:CaCO3;
(3)普通玻璃:Na2SiO3、CaSiO3、SiO2;
(4)石英、水晶:SiO2.
分析 (1)刚玉主要成分为氧化铝;
(2)大理石、石灰石主要成分为碳酸钙;
(3)普通水泥、普通玻璃的主要成分为硅酸盐;
(4)石英、水晶的主要成分为二氧化硅.
解答 解:(1)刚玉主要成分为氧化铝,化学式为:Al2O3,
故答案为:Al2O3;
(2)大理石、石灰石主要成分是碳酸钙,其化学式是CaCO3,
故答案为:CaCO3;
(3)制造普通玻璃的主要原料是:纯碱、石灰石和石英.在玻璃窑中强热时的主要发生反应:SiO2+Na2CO3 $\frac{\underline{\;高温\;}}{\;}$Na2SiO3+CO2↑,SiO2+CaCO3 $\frac{\underline{\;高温\;}}{\;}$CaSiO3+CO2↑,所以普通玻璃主要成分为:Na2SiO3、CaSiO3、SiO2,
故答案为:Na2SiO3、CaSiO3、SiO2;
(4)石英、水晶的主要成分为二氧化硅,其化学式为:SiO2,
故答案为:SiO2.
点评 本题难度不大,熟练掌握常见化学物质的名称、俗称、主要成分、化学式是正确解答此类题的关键.

练习册系列答案
 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案
相关题目
7.常温下,下列各组离子在指定溶液中一定能大量共存的是( )
| A. | 遇到石蕊试液变红的溶液:Na+、NH4+、K+、NO3- | |
| B. | 遇[Fe(CN)6]3-产生蓝色沉淀的溶液:Ca 2+、Cl-、ClO-、Fe3+ | |
| C. | 水电离出的c(OH-)=1×10-12 mol/L的溶液:S2O3-、Cl-、NO3-、Na+ | |
| D. | 与铝反应产生大量氢气的溶液:Ba 2+、HCO3-、I-、Fe3+ |
1.0.1mol某烃在足量O2中完全燃烧,得到标准状况下13.44L CO2和5.4g水,该烃的分子式为( )
| A. | CH4 | B. | C2H4 | C. | C3H8 | D. | C6H6 |
3.设NA为阿伏伽德罗常数的值.下列说法正确的是( )
| A. | 标准状况下,11.2LN0与02的混合气体含有的分子数为0.5NA | |
| B. | 常温下,1mol铁与足量的硫反应,转移电子为2NA | |
| C. | 常温常压下,22gC3H8中含有的共价键数8NA | |
| D. | 0.1mol/L的CH3COONa溶液20mL,含有CH3COO-数目为0.002NA |
20.J、L、M、R、T是原子序数依次增大的短周期主族元素,J、R在周期表中的相对位置如右表;J元素最低负化合价的绝对值与其原子最外层电子数相等;M是地壳中含量最多的金属元素.
(1)M的离子结构示意图为 ;元素T在周期表中位于第ⅦA族.
;元素T在周期表中位于第ⅦA族.
(2)J和氢组成的化合物分子有6个原子,其结构简式为CH2=CH2.
(3)L的最简单气态氢化物甲的水溶液显碱性.
①在微电子工业中,甲的水溶液可作刻蚀剂H2O2 的清除剂,所发生反应的产物不污染环境,其化学方程式为2NH3.H2O+3H2O2═N2↑+8H2O.
②一定条件下,甲在固定体积的密闭容器中发生分解反应(△H>0)并达平衡后,仅改变下表中反应条件x,该平衡体系中随x递增y递减的是bc(选填序号).
(4)M和T形成的化合物在潮湿的空气中冒白色烟雾,反应的化学方程式为:AlCl3+3H2O?Al(OH)3+3HCl↑.
(5)用等式表示R的氢化物与NaOH溶液反应后生成正盐的溶液中所有离子浓度之间的关系c(Na+)+c(H+)=c(OH-)+c(HS-)+2c(S2-).
| J | ||||
| R |
 ;元素T在周期表中位于第ⅦA族.
;元素T在周期表中位于第ⅦA族.(2)J和氢组成的化合物分子有6个原子,其结构简式为CH2=CH2.
(3)L的最简单气态氢化物甲的水溶液显碱性.
①在微电子工业中,甲的水溶液可作刻蚀剂H2O2 的清除剂,所发生反应的产物不污染环境,其化学方程式为2NH3.H2O+3H2O2═N2↑+8H2O.
②一定条件下,甲在固定体积的密闭容器中发生分解反应(△H>0)并达平衡后,仅改变下表中反应条件x,该平衡体系中随x递增y递减的是bc(选填序号).
| 选项 | a | b | c | d |
| x | 温度 | 温度 | 加入H2的物质的量 | 加入甲的物质的量 |
| y | 平衡常数K | 甲的物质的量 | 甲的转化率 | 生成物物质的量总和 |
(5)用等式表示R的氢化物与NaOH溶液反应后生成正盐的溶液中所有离子浓度之间的关系c(Na+)+c(H+)=c(OH-)+c(HS-)+2c(S2-).
 .
.