题目内容
11.设NA代表阿伏加德罗常数的值.下列说法正确的是( )| A. | 1mol乙酸和1mol乙醇充分反应生成的水分子数为NA | |
| B. | 0.1mol葡萄糖分子中官能团数目为0.5NA | |
| C. | 在含NA个硅原子的二氧化硅晶体中含有2NA个Si-O键 | |
| D. | 25℃时,1L、pH=11的Na2CO3溶液中水电离出来的OH-数目为10-3NA |
分析 A、乙酸和乙醇的酯化反应,该反应为可逆反应,反应物不可能完全转化成生成物;
B、葡萄糖分子中含有5个羟基、1个醛基,总共含有6个官能团;
C、1个硅原子形成4条硅氧键;
D、依据碳酸钠溶液中存在离子积常数结合盐类水解和水的电离平衡分析计算.
解答 解:A、酯化反应为可逆反应,所以1mol乙醇和1mol乙酸生成的水的物质的量一定小于1mol,生成的水分子数小于NA,故A错误;
B、0.1mol葡萄糖分子中含有0.5mol羟基、0.1mol醛基,总共含有0.6mol官能团,含有官能团数目为0.6NA,故B错误;
C、1个硅原子形成4条硅氧键,故含NA个硅原子的二氧化硅晶体中含4NA个硅氧键,故C错误;
D、25℃时,pH=11的Na2CO3的水溶液中,碳酸根离子水解,氢氧根离子是水全部电离出的离子,pH=11则c(H+)=1.0×10-11mol/L,则c(OH-)=$\frac{Kw}{c({H}^{+})}$=$\frac{1.0×1{0}^{-14}}{1.0×1{0}^{-11}}$=1.0×10-3mol/L,故溶液中水电离出来的OH-数目为10-3NA,故D正确,
故选D.
点评 本题考查阿伏加德罗常数的综合应用,题目难度中等,注意掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系,试题有利于培养学生的逻辑推理能力,提高学生灵活运用基础知识解决实际问题的能力.

练习册系列答案
 小学课时特训系列答案
小学课时特训系列答案
相关题目
7.下列关于晶体的说法正确的是( )
| A. | 离子晶体中一定含金属阳离子 | |
| B. | 只要含有金属阳离子的晶体就一定是离子晶体 | |
| C. | 分子晶体的熔点不一定比金属晶体的熔点低 | |
| D. | 在共价化合物分子中,各原子都形成8电子结构 |
2.下列各组物质中,仅用水及物质间相互反应不能一一区别的一组是( )
| A. | Na2O2 Al2(SO4)3 MgCl2 K2CO3 | |
| B. | BaCl2 Na2SO4 (NH4)2SO4 KOH | |
| C. | AgNO3 NaCl KCl CuCl2 | |
| D. | Fe2(SO4)3 K2CO3 KHSO4 NH4Cl |
19.下列现象或事实的解释正确的是( )
| 选项 | 现象或事实 | 解释 |
| A | Na2CO3•10H2O晶体久置后变成白色粉末 | Na2CO3•10H2O与空气中的CO2作用生成 NaHCO3 |
| B | 青铜(铜锡合金)在空气中久置表面会生成一层铜绿 | 发生电化学腐蚀,铜做负极 |
| C | 将过量SO2通入到KMnO4溶液中,溶液褪色 | SO2具有还原性,与 KMnO4发生氧化还原反应 |
| D | 向含有酚酞的 Na2CO3溶液中加入BaCl2固体, 溶液红色变浅 | Na2CO3溶液中的电离平衡发生移动 |
| A. | A | B. | B | C. | C | D. | D |
6.下列离子方程式书写正确的是( )
| A. | 硫酸铜溶液吸收H2S:Cu2++S2-=CuS↓ | |
| B. | 氧化铁溶于氢碘酸:Fe2O3+6H+=2Fe3++3H2O | |
| C. | 向饱和碳酸钠溶液中通入足量CO2:CO32-+CO2+H2O=2HCO3- | |
| D. | 向KA1(SO4)2溶液中加入过量的Ba(OH)2溶液:Al3++2SO42-+2Ba2++4OH-=2BaSO4↓+AlO2-+2H2O |
16.下列化学用语正确的是( )
| A. | Zn的电子排布式:1s22s22p63s23p64s2 | |
| B. | Fe2+的电子排布式:[Ar]3d6 | |
| C. | C的价电子轨道表示式: | |
| D. | HClO的电子式: |
20.下列关于有机化合物的说法不正确的是( )
| A. | 淀粉和纤纤维素互为同分异构体 | |
| B. | 油脂在碱性条件下的水解反应称为皂化反应 | |
| C. | 分子式为C5H10O2的有机物中能与NaHCO3溶液反应的有4种 | |
| D. | 在加热条件下,用新制的氢氧化铜悬浊液可鉴别乙醇和葡萄糖 |
20. 常温下将NaOH溶液添加到己二酸(H2X)溶液中,混合溶液的pH与离子浓度变化的关系如图所示.下列叙述错误的是( )
常温下将NaOH溶液添加到己二酸(H2X)溶液中,混合溶液的pH与离子浓度变化的关系如图所示.下列叙述错误的是( )
 常温下将NaOH溶液添加到己二酸(H2X)溶液中,混合溶液的pH与离子浓度变化的关系如图所示.下列叙述错误的是( )
常温下将NaOH溶液添加到己二酸(H2X)溶液中,混合溶液的pH与离子浓度变化的关系如图所示.下列叙述错误的是( )| A. | Ka2(H2X)的数量级为10-6 | |
| B. | 曲线N表示pH与lg$\frac{c(H{X}^{-})}{c({H}_{2}X)}$的变化关系 | |
| C. | NaHX溶液中c(H+)>c(OH-) | |
| D. | 当混合溶液呈中性时,c(Na+)>c(HX-)>c(X2-)>c(OH-)=c(H+) |
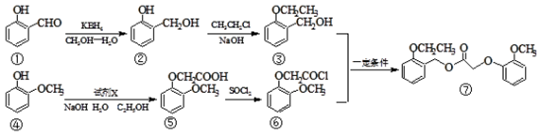
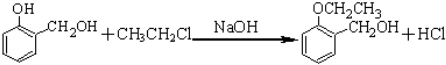 .
.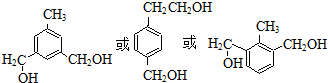 (写出一种
(写出一种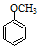 +HBr→
+HBr→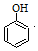 +CH3Br
+CH3Br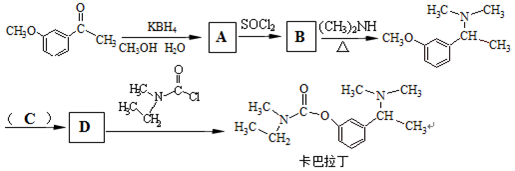
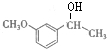 B:
B: C:HBrD:
C:HBrD: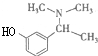 .
.