题目内容
16.生态农业涉及农家废料的综合利用,某种肥料经发酵得到一种含甲烷、二氧化碳、氮气的混合气体.4.48L(标准状况)该气体通过盛有红热CuO粉末的硬质玻璃管,发生的反应为:CH4+4CuO=CO2+2H2O+4Cu.当甲烷完全反应后,硬质玻璃管的质量减轻9.6g.将反应后产生的气体通入过量的澄清石灰水中,充分吸收,生成沉淀18g.(1)原混合气体中甲烷的质量是多少?
(2)原混合气体中氮气的物质的量是多少?
分析 (1)由反应CH4+4CuO=CO2+2H2O+4Cu,当甲烷完全反应后,硬质玻璃管的质量减轻9.6g,可知减少的质量为CuO中氧元素的质量,利用差量法计算甲烷的物质的量,再根据m=nM计算甲烷质量;
(2)将反应后产生的气体通过过量的澄清石灰水中,充分吸收,生成沉淀8.5g为CaCO3的质量,可知二氧化碳总的物质的量,根据碳元素守恒计算原混合气体中二氧化碳物质的量,再计算氮气物质的量.
解答 解:(1)设甲烷的物质的量为x,当甲烷完全反应后,硬质玻璃管的质量减轻9.6g,则:
CH4+4CuO=CO2+2H2O+4Cu△m
1mol 16×4g
x 9.6g
所以x=$\frac{1mol×9.6g}{64g}$=0.15mol,
故甲烷的质量为0.15mol×16g/mol=2.4g
答:原混合气体中甲烷的质量2.4g;
(2)由反应后产生的气体通过过量的澄清石灰水中,充分吸收,生成沉淀18g为CaCO3的质量,由C原子守恒可知:n总(CO2)=n(CaCO3)=$\frac{18g}{100g/mol}$=0.18mol,
根据碳原子守恒,则原混合气体中n(CO2)=0.18mol-0.15mol=0.03mol,
原混合气体的总物质的量为 $\frac{4.48L}{22.4L/mol}$=0.2mol,
所以氮气的物质的量为:0.2mol-0.15mol-0.03mol=0.02mol,
答:原混合气体中氮气的物质的量为0.02mol.
点评 本题考查化学反应方程式的计算,注意利用差量法、守恒法进行解答,难度不大,注意生成碳酸钙沉淀的二氧化碳来源.

练习册系列答案
 期末宝典单元检测分类复习卷系列答案
期末宝典单元检测分类复习卷系列答案
相关题目
6.某溶液中只含有Na+、Fe3+、Cl-、SO42-四种离子,已知Na+、Fe3+、Cl-的个数比为1:2:3,则溶液中Fe3+和SO42-的个数比为( )
| A. | 1:1 | B. | 1:2 | C. | 1:3 | D. | 1:4 |
4.下列叙述正确的是( )
| A. | 常温下,pH=5的NaHC2O4溶液中:c(C2O42-)>c(H2C2O4) | |
| B. | 在0.1mol•L-1 CH3COONa溶液中:n(OH-)+0.1mol>n(CH3COOH)+n(H+)+n(Na+) | |
| C. | 向AgBr的饱和溶液中加入NaCl固体,有白色固体析出,说明AgCl比AgBr更难溶 | |
| D. | 10mL 0.01mol•L-1 H2SO4溶液与10mL 0.01mol•L-1 NaOH溶液充分混合,若混合后溶液的体积为20mL,则溶液的pH=7 |
11.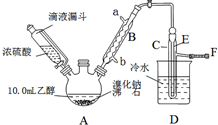 实验室用乙醇、浓硫酸和溴化钠反应来制备溴乙烷,其反应原理和实验的装置如下(反应需要加热,图中省去了加热装置):H2SO4(浓)+NaBr$\frac{\underline{\;\;△\;\;}}{\;}$NaHSO4+HBr↑.CH3CH2OH+HBr$\stackrel{△}{→}$CH3CH2Br+H2O.有关数据见表:
实验室用乙醇、浓硫酸和溴化钠反应来制备溴乙烷,其反应原理和实验的装置如下(反应需要加热,图中省去了加热装置):H2SO4(浓)+NaBr$\frac{\underline{\;\;△\;\;}}{\;}$NaHSO4+HBr↑.CH3CH2OH+HBr$\stackrel{△}{→}$CH3CH2Br+H2O.有关数据见表:
(1)A装置的名称是三颈烧瓶.
(2)实验中用滴液漏斗代替分液漏斗的优点为平衡压强,使浓硫酸顺利流下.
(3)给A加热温度过高或浓硫酸的浓度过大,均会使C中收集到的粗产品呈橙色,原因是A中发生了副反应,写出此反应的化学方程式2HBr+H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$Br2↑+SO2↑+2H2O.
(4)给A加热的目的是升高温度加快反应速率,同时使生成的溴乙烷气化分离出来促进平衡移动,F接橡皮管导入稀NaOH溶液,其目的主要是吸收SO2、Br2、HBr防止空气污染.
(5)图中C中的导管E的末端须在水面以下,其目的是使溴乙烷充分冷凝,提高产率.
(6)为了除去产品中的主要杂质,最好选择下列C(选填序号)溶液来洗涤所得粗产品.
A.氢氧化钠 B.碘化钾 C.亚硫酸钠 D.碳酸氢钠
(7)粗产品用上述溶液洗涤、分液后,再经过蒸馏水洗涤、分液,然后加入少量的无水硫酸镁固体,静置片刻后过滤,再将所得滤液进行蒸馏,收集到的馏分约10.0g.
①在上述提纯过程中每次分液时产品均从分液漏斗的下口(上口或下口)取得.
②从乙醇的角度考虑,本实验所得溴乙烷的产率是53.3%.
 实验室用乙醇、浓硫酸和溴化钠反应来制备溴乙烷,其反应原理和实验的装置如下(反应需要加热,图中省去了加热装置):H2SO4(浓)+NaBr$\frac{\underline{\;\;△\;\;}}{\;}$NaHSO4+HBr↑.CH3CH2OH+HBr$\stackrel{△}{→}$CH3CH2Br+H2O.有关数据见表:
实验室用乙醇、浓硫酸和溴化钠反应来制备溴乙烷,其反应原理和实验的装置如下(反应需要加热,图中省去了加热装置):H2SO4(浓)+NaBr$\frac{\underline{\;\;△\;\;}}{\;}$NaHSO4+HBr↑.CH3CH2OH+HBr$\stackrel{△}{→}$CH3CH2Br+H2O.有关数据见表:| 乙醇 | 溴乙烷 | 溴 | |
| 状态 | 无色液体 | 无色液体 | 深红色液体 |
| 密度/(g•cm-3) | 0.79 | 1.44 | 3.1 |
| 沸点/℃ | 78.5 | 38.4 | 59 |
(2)实验中用滴液漏斗代替分液漏斗的优点为平衡压强,使浓硫酸顺利流下.
(3)给A加热温度过高或浓硫酸的浓度过大,均会使C中收集到的粗产品呈橙色,原因是A中发生了副反应,写出此反应的化学方程式2HBr+H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$Br2↑+SO2↑+2H2O.
(4)给A加热的目的是升高温度加快反应速率,同时使生成的溴乙烷气化分离出来促进平衡移动,F接橡皮管导入稀NaOH溶液,其目的主要是吸收SO2、Br2、HBr防止空气污染.
(5)图中C中的导管E的末端须在水面以下,其目的是使溴乙烷充分冷凝,提高产率.
(6)为了除去产品中的主要杂质,最好选择下列C(选填序号)溶液来洗涤所得粗产品.
A.氢氧化钠 B.碘化钾 C.亚硫酸钠 D.碳酸氢钠
(7)粗产品用上述溶液洗涤、分液后,再经过蒸馏水洗涤、分液,然后加入少量的无水硫酸镁固体,静置片刻后过滤,再将所得滤液进行蒸馏,收集到的馏分约10.0g.
①在上述提纯过程中每次分液时产品均从分液漏斗的下口(上口或下口)取得.
②从乙醇的角度考虑,本实验所得溴乙烷的产率是53.3%.
1.反应2NH3(g)?N2(g)+3H2(g)在密闭容器内进行,已知起始时NH3的物质的量浓度为2.0mol/L,5s后为1.2mol/L,则此段时间内用氨的浓度变化表示该反应的平均速率为( )
| A. | 1.6 mol/(L•s) | B. | 0.16 mol/(L•s) | C. | 0.32mol/(L•s) | D. | 0.8 mol/(L•s) |
8.向硫酸铜溶液中加入一小块金属钠后,观察到的现象有( )
①钠浮于液面上 ②熔化成小球 ③发出嘶嘶的响声,放出气体 ④有蓝色沉淀产生 ⑤钠周围蓝色沉淀部分变黑 ⑥析出大量红色的铜 ⑦小球沉在溶液底部 ⑧小球在液面上游动、逐渐变小,直至消失.
①钠浮于液面上 ②熔化成小球 ③发出嘶嘶的响声,放出气体 ④有蓝色沉淀产生 ⑤钠周围蓝色沉淀部分变黑 ⑥析出大量红色的铜 ⑦小球沉在溶液底部 ⑧小球在液面上游动、逐渐变小,直至消失.
| A. | ①②③④⑤⑥ | B. | ①②③④⑤⑧ | C. | ①②③⑥⑧ | D. | ②⑥⑦ |
5.25℃时,下列溶液中水的电离程度最小的是( )
| A. | 0.01mol/L盐酸 | B. | 0.01mol/L Na2CO3溶液 | ||
| C. | pH=4NaHSO3溶液 | D. | pH=11氨水 |
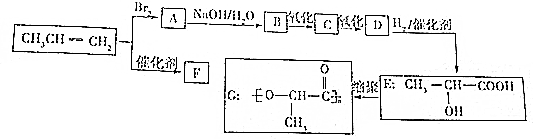
 .
.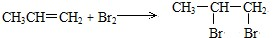 ,反应类型:加成反应;
,反应类型:加成反应;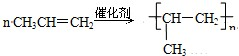 ,反应类型:加聚反应.
,反应类型:加聚反应.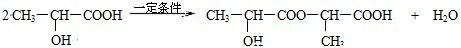 .
.