题目内容
3. 已知A、B、C、D、E五种元素是周期表中前四周期元素,且原子序数依次增大.其中A、B、C为同周期的非金属元素,且B、C原子中均有两个未成对电子.D、E为同周期元素且分别位于s区和d区.五种元素所有的s能级电子均为全充满.E的d能级电子数等于A、B、C最高能层的p能级电子数之和.回答下列问题:
已知A、B、C、D、E五种元素是周期表中前四周期元素,且原子序数依次增大.其中A、B、C为同周期的非金属元素,且B、C原子中均有两个未成对电子.D、E为同周期元素且分别位于s区和d区.五种元素所有的s能级电子均为全充满.E的d能级电子数等于A、B、C最高能层的p能级电子数之和.回答下列问题:(1)五种元素中,电负性最大的是O(填元素符号).
(2)E常有+2,+3两种价态,画出E2+离子的价电子排布图
 .
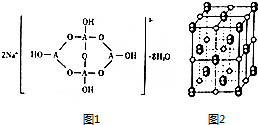
.(3)自然界中,含A的钠盐是一种天然矿藏,其化学式写作Na2A4O7•10H2O,实际上它的结构单元是由两个H3AO3和两个[A(OH)4]-缩合而成的双六元环,应该写成Na2[A4O5(OH)4]•8H2O,其结构式如图1,它的阴离子可形成链状结构.
①A原子的杂化轨道类型为sp2、sp3.
②该阴离子由极性键和配位键构成,请在图1中用“→”标出其中的配位键.该阴离子通过氢键相互结合形成链状结构.
③已知H3AO3为一元弱酸,根据上述信息,用离子方程式解释分析H3AO3为一元酸的原因(用元素符号表示)H3BO3+H2O?[B(OH)4]-+H+.
(4)E2+离子在水溶液中以[E(H2O)6]2+形式存在,向含E2+离子的溶液中加入氨水,可生成更稳定的[E(NH3)6]2+离子,其原因是N元素电负性更小,更易给出孤对电子形成配位键.[E(NH3)6]2+的立体构型为正八面体.
(5)由元素B、D组成的某离子化合物的晶胞结构如图2,写出该物质的电子式
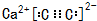 ,若晶胞的长宽高分别为520pm、520pm和690pm,该晶体密度为2.28g/cm3(保留到小数点后两位).
,若晶胞的长宽高分别为520pm、520pm和690pm,该晶体密度为2.28g/cm3(保留到小数点后两位).
分析 A、B、C、D、E五种元素是周期表中前四周期元素,且原子序数依次增大.其中A、B、C为同周期的非金属元素,三元素处于短周期,且B、C原子中均有两个未成对电子,二者外围电子数排布分别为ns22p2、ns22p4,结合A为非金属元素,可知A为硼元素、B为碳元素、C为O元素;D、E为同周期元素且分别位于s区和d区,则二者处于第四周期,五种元素所有的s能级电子均为全充满,则D为Ca;E的d能级电子数等于A、B、C最高能层的p能级电子数之和,则E的d能级电子数为1+2+4=7,即E的外围电子排布为3d74s2,故E为Fe.
(1)非金属性越强电负性越大,同周期自左而右电负性增大;
(2)E为Fe,Fe2+离子的价电子排布式为3d6,根据泡利原理、洪特规则画出价电子排布图;,
(3)①A为B原子,结构中B原子形成3个单键、4个单键(含有1个配位键),B原子核外最外层的3个电子全部参与成键;
②形成4个键的B原子中含有1个配位键,氢氧根离子中氧原子与B原子之间形成配位键;该阴离子通过氢键相互结合形成链状结构;
③H3AO3为一元弱酸,与水形成配位键,电离出[A(OH)4]-与氢离子;
(4)N元素电负性更小,更易给出孤对电子形成配位键,[Fe(NH3)6]2+的立体构型为正八面体,
(5)由元素C、Ca组成的某离子化合物为CaC2,属于离子化合物,C22-离子中碳原子之间形成3对共用电子对;
晶胞中钙离子、C22-数目相等,根据均摊法计算晶胞中钙离子、C22-数目数目,再计算晶胞质量,根据ρ=$\frac{m}{V}$计算晶胞密度.
解答 解:A、B、C、D、E五种元素是周期表中前四周期元素,且原子序数依次增大.其中A、B、C为同周期的非金属元素,三元素处于短周期,且B、C原子中均有两个未成对电子,二者外围电子数排布分别为ns22p2、ns22p4,结合A为非金属元素,可知A为硼元素、B为碳元素、C为O元素;D、E为同周期元素且分别位于s区和d区,则二者处于第四周期,五种元素所有的s能级电子均为全充满,则D为Ca;E的d能级电子数等于A、B、C最高能层的p能级电子数之和,则E的d能级电子数为1+2+4=7,即E的外围电子排布为3d74s2,故E为Co.
(1)非金属性越强电负性越大,同周期自左而右电负性增大,五种元素中,O元素电负性最大,
故答案为:O;
(2)E为Co,Co2+离子的价电子排布图 ,
,
故答案为: ;
;
(3)①A为B原子,结构中B原子形成3个单键、4个单键(含有1个配位键),B原子核外最外层的3个电子全部参与成键,杂化杂化轨道类型为sp2、sp3,
故答案为:sp2、sp3;
②形成4个键的B原子中含有1个配位键,氢氧根离子中氧原子与B原子之间形成配位键,图1中用“→”标出其中的配位键为: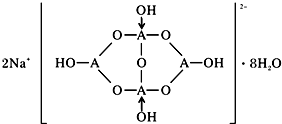 ,该阴离子通过氢键相互结合形成链状结构,
,该阴离子通过氢键相互结合形成链状结构,
故答案为: ;氢键;
;氢键;
③H3AO3为一元弱酸,与水形成配位键,电离出[A(OH)4]-与氢离子,用离子方程式解释分析H3BO3为一元酸的原因:H3BO3+H2O?[B(OH)4]-+H+,
故答案为:H3BO3+H2O?[B(OH)4]-+H+;
(4)Fe2+离子在水溶液中以[Fe(H2O)6]2+形式存在,向含Fe2+离子的溶液中加入氨水,可生成更稳定的[Fe(NH3)6]2+离子,其原因是:N元素电负性更小,更易给出孤对电子形成配位键,[Fe(NH3)6]2+的立体构型为正八面体,
故答案为:N元素电负性更小,更易给出孤对电子形成配位键;正八面体;
(5)由元素C、Ca组成的某离子化合物为CaC2,该物质的电子式为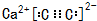 ,
,
晶胞中钙离子、C22-数目相等,C22-数目数目为8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,则晶胞质量为4×$\frac{64}{6.02×1{0}^{23}}$g,若晶胞的长宽高分别为520pm、520pm和690pm,该晶体密度为4×$\frac{64}{6.02×1{0}^{23}}$g÷(520×10-10cm×520×10-10cm×690×10-10cm)=2.28g/cm3,
故答案为: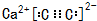 ;2.28.
;2.28.
点评 本题是对物质结构与性质的考查,涉及核外电子排布、电负性、杂化方式、微粒结构、配位键、晶胞计算等,推断元素是解题关键,侧重考查学生分析推理能力、知识迁移运用能力,需要学生具备扎实的基础.

 期末集结号系列答案
期末集结号系列答案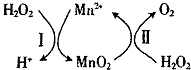 锰的化合物是优良的催化剂,可用于干电池原料生产等.
锰的化合物是优良的催化剂,可用于干电池原料生产等.(1)锌锰干电池的反应为2MnO2+Zn+2NH4Cl=2MnO(OH)+Zn(NH3)2Cl2,MnO(OH)中锰元素的化合价为+3.
(2)向废电池还原后的废液(含有Mn2+、Fe2+、Zn2+等)中逐滴滴加Na2S溶液,最先生成的沉淀为ZnS(填化学式).[已知Ksp(MnS)=1.4×10-15,Ksp(ZnS)=2.9×10 -25,Ksp(FeS)=6.0×10-18]
(3)Mn2+催化H2O2分解:2H2O2(l)=2H2O(l)+O2(g)△H1,其反应机理如图:
①已知反应Ⅱ为MnO2(s)+H2O2(1)+2H+ ( aq)=Mn2+ (aq)+O2(g)+2H2O(1)△H2.写出反应 I的热化学方程式(焓变用△H1和△H2表示):H2O2(1)+Mn2+(aq)=2H+(aq)+MnO2(s)△H=△H1-△H2.
②某温度时,向10mL0.4mol/L H2O2液中滴入1滴MnSO4发生分解:2H2O2=2H2O+O2,测得不同时刻生成O2的体积(已折算为标准状况下的体积)如表:
| t/min | 0 | 2 | 4 | 6 |
| V(O2)mL | 0 | 9.9 | 17.2 | 22.4 |
(4)锰基催化剂是合成甲醇、二甲醚的催化剂.已知:
| 反应 | 平衡常数KP | |
| 773K | 873K | |
| Ⅰ.CO2(g)+4H2(g)?CH4(g)+2H2(g) | 19.4 | 0.803 |
| Ⅱ.CO2(g)+3H2(g)?CH3OH(g)+H2O(g) | 6.07×10-9 | 3.65×10-9 |
②反应Ⅱ的平衡常数表达式为K=$\frac{c(C{H}_{3}OH)×c({H}_{2}O)}{c(C{O}_{2})×{c}^{3}({H}_{2})}$.
| A. | pH=3的溶液中:K+、Ba2+、Cl-、Br- | |
| B. | 含有0.1mol•L-1Fe3+的溶液中:K+、Mg2+、I-、SO42- | |
| C. | 含有0.1mol•L-1NO3-的溶液中:Na+、H+、SO42-、Fe2+ | |
| D. | 含有大量AlO2-的溶液中:NH4+、NO3-、Cl-、H+ |
| A. | 常温下,22gCO2含碳氧双键数目为2NA | |
| B. | 12.0gNaHSO4固体中含阳离子数为0.1NA | |
| C. | 标准状况下,22.4LBr2中所含分子数为NA | |
| D. | 7.8gNa2O2与足量的水反应转移电子数为0.2NA |
| A. | 溶液呈酸性说明草酸是弱酸 | B. | c(K+)+c(H+)═c(HC2O4-)+c(OH-)+2c(C2O42-) | ||
| C. | c(K+)>c(HC2O4-)>c(C2O42-)>c(H+) | D. | c(H2C2O4)>c(C2O42-) |
| A. | 钠与水反应:Na+2H2O═Na++2OH-+H2↑ | |
| B. | 氧化铝与盐酸:O2-+2H+═H2O | |
| C. | NaOH溶液与小苏打溶液反应:HCO3-+OH-═CO32-+H2O | |
| D. | 氯气通入水中:Cl2+H2O?2H++Cl-+ClO- |
| A. | Y的简单气态氢化物在一定条件下可被Q单质氧化 | |
| B. | Y的简单离子半径小于Z的简单离子半径 | |
| C. | Q可分别与X、Y、Z、W形成化学键类型相同的化合物 | |
| D. | Z最高价氧化物对应的水化物分别与X、Y最高价氧化物对应的水化物反应生成1mol水时所放出的热量相同 |
 化学材料的研发和使用,为开发太阳能资源,寻求经济发展的新动力提供有力支撑.请根据你所学知识回答:
化学材料的研发和使用,为开发太阳能资源,寻求经济发展的新动力提供有力支撑.请根据你所学知识回答: