题目内容
17.用NA表示阿伏加德罗常数,下列说法正确的是( )| A. | 1 mol•L-1的NaCl溶液中,Na+数目为NA | |
| B. | 标准状况下,1 mol Cl2溶于水,转移电子的数目为NA | |
| C. | 1 mol Na2O和1 mol Na2O2中,所含阴离子的数目均为NA | |
| D. | 含2 mol H2SO4的浓硫酸与足量铜粉完全反应,生成气体分子的数目为NA |
分析 A、溶液体积不明确;
B、氯气和水的反应为可逆反应;
C、氧化钠和过氧化钠均由2个阳离子和1个阴离子构成;
D、铜只能与浓硫酸反应,与稀硫酸不反应.
解答 解:A、溶液体积不明确,故溶液中的钠离子的个数无法计算,故A错误;
B、氯气和水的反应为可逆反应,不能进行彻底,故转移的电子数小于NA个,故B错误;
C、氧化钠和过氧化钠均由2个阳离子和1个阴离子构成,故1mol氧化钠中和1mol过氧化钠中含有的阴离子均为NA个,故C正确;
D、铜只能与浓硫酸反应,与稀硫酸不反应,故2mol硫酸不能反应完全,故生成的气体分子个数小于NA个,故D错误.
故选C.
点评 本题考查了一定物质的量浓度溶液的配制过程中的计算和误差分析,属于基础型题目,难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
7.在一定条件下,分别以高锰酸钾、氯酸钾、过氧化氢为原料制取氧气,当制得同温、同压下相同体积的氧气时,三个反应中转移的电子数之比为(2KMnO4$\frac{\underline{\;\;△\;\;}}{\;}$K2MnO4+MnO2+O2↑,2KClO3$\frac{\underline{MnO_2}}{△}$2KCl+3O2↑,2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$O2↑+2H2O)( )
| A. | 1:1:1 | B. | 2:2:1 | C. | 2:3:1 | D. | 4:3:2 |
5.下列关于化学反应的说法中正确的是( )
| A. | 同时改变两个变量来研究反应速率的变化,能更快得出有关规律 | |
| B. | 放热反应的反应速率总是大于吸热反应的反应速率 | |
| C. | 一定条件下,使用催化剂能加快反应速率并提高反应物的平衡转化率 | |
| D. | 相同温度下,H2(g)+CO2(g)?CO(g)+H2O(g)中,密闭容器中两种反应物浓度为0.020 mol/L的反应速率大于两种反应物浓度为0.010 mol/L的反应速率 |
7.已知:①2H2O?H3O++OH-;②液体N2O4电离可得电子数相差18的阳离子(X)和阴离子(Y);③铜与液体N2O4反应可以生成无水硝酸铜.根据以上信息,判断下列说法中正确的是( )
| A. | N2O4属于离子化合物 | B. | X的离子符号为N2O+ | ||
| C. | Y的离子符号为NO2- | D. | 铜与液体N2O4反应会生成NO气体 |
 有如下有机物:(每空一分)
有如下有机物:(每空一分) ②
② ③
③ ④CH3CH=CHCH3 ⑤
④CH3CH=CHCH3 ⑤ ⑥
⑥ ⑦
⑦
 ,其分子中碳原子sp3杂化.
,其分子中碳原子sp3杂化.
 +
+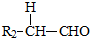 $→_{△}^{稀NaOH}$
$→_{△}^{稀NaOH}$ (R,R’为烃基或氢)
(R,R’为烃基或氢)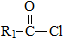 +R2OH$\stackrel{一定条件}{→}$
+R2OH$\stackrel{一定条件}{→}$ +HCl (R,R’为烃基)
+HCl (R,R’为烃基) .
.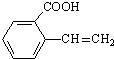 、
、 、
、 、
、 (其中之一).
(其中之一). .
. AlN是一种新型高温结构陶瓷,工业上可用图中的反应①制备,反应②常用于处理汽车尾气.B、D是单质,A、E、F、G是氧化物,A是形成温室效应的气体,M能使湿润的红色石蕊试纸变蓝的气体(转化过程中的部分产物已略去).
AlN是一种新型高温结构陶瓷,工业上可用图中的反应①制备,反应②常用于处理汽车尾气.B、D是单质,A、E、F、G是氧化物,A是形成温室效应的气体,M能使湿润的红色石蕊试纸变蓝的气体(转化过程中的部分产物已略去). .
.