题目内容
15.已知:Sn2+易被氧化成Sn4+.某研究性学习小组的同学通过下列流程测定金属锡样品的而纯度:①取6.13g金属锡试样溶于盐酸中;
②在反应后的溶液中加入过量的FeCl3溶液;
③用已知浓度的K2CrO7溶液滴定生成的Fe2+,共用去1.00mol/L K2Cr2O7溶液16.0mL,发生的反应为6FeCl2+K2Cr2O7+14HCl═6FeCl3+2KCl+2CrCl3+7H2O.
请回答下列问题:
(1)写出流程①中反应的离子方程式:Sn+2H+=Sn2++H2↑;
(2)写出流程②中反应的化学方程式:2FeCl3+SnCl2=2FeCl2+SnCl4;
(3)要完成步骤③,K2Cr2O7溶液应装在酸式滴定管(填仪器名称)中;
(4)计算试样中锡的质量分数(假定杂质不参加反应,要求有必要的计算过程;计算结果保留两位小数).
分析 (1)Sn与盐酸反应生成盐和氢气;
(2)加入过量的FeCl3溶液,Sn2+被氧化成Sn4+,还生成氯化亚铁;
(3)K2Cr2O7溶液具有强氧化性,可氧化腐蚀橡胶;
(4)结合Sn+2HCl=SnCl2+H2↑、2FeCl3+SnCl2=2FeCl2+SnCl4、6FeCl2+K2Cr2O7+14HCl═6FeCl3+2KCl+2CrCl3+7H2O可知,存在3Sn~3Sn2+~6Fe2+~Cr2O72-,以此计算.
解答 解:(1)Sn与盐酸反应生成盐和氢气,离子反应为Sn+2H+=Sn2++H2↑,故答案为:Sn+2H+=Sn2++H2↑;
(2)加入过量的FeCl3溶液,Sn2+被氧化成Sn4+,还生成氯化亚铁,化学反应为2FeCl3+SnCl2=2FeCl2+SnCl4,故答案为:2FeCl3+SnCl2=2FeCl2+SnCl4;
(3)K2Cr2O7溶液具有强氧化性,可氧化腐蚀橡胶,则K2Cr2O7溶液应装在酸式滴定管中,故答案为:酸式滴定管;
(4)由Sn+2HCl=SnCl2+H2↑、2FeCl3+SnCl2=2FeCl2+SnCl4、6FeCl2+K2Cr2O7+14HCl═6FeCl3+2KCl+2CrCl3+7H2O可知存在3Sn~3Sn2+~6Fe2+~Cr2O72-,
设试样中锡的质量分数为a%,
3Sn~3Sn2+~6Fe2+~Cr2O72-,
3×118.7g/mol 1mol
6.13g×a% 1.00mol/L×0.016L
a%=$\frac{3×118.7g/mol×1.00mol/L×0.016L}{1mol×6.13g}$=92.95%,
答:试样中锡的质量分数为92.95%.
点评 本题考查氧化还原反应的计算,为高频考点,把握发生的反应及物质的量关系为解答的关键,侧重分析与计算能力的考查,题目难度不大.

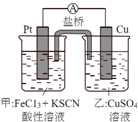
| A. | 该原电池的正极反应是Cu2++2e-=Cu | |
| B. | 甲烧杯中溶液的血红色逐渐变浅 | |
| C. | 盐桥中的SO42-流向甲烧杯 | |
| D. | 若将甲烧杯中的溶液换成稀硝酸,电流表指针反向偏转 |
| A. | 用溴水代替碘水进行萃取实验 | |
| B. | 用过量的氯气进行性质实验 | |
| C. | 用乙烯和氧气在银作催化剂的条件下制备环氧乙烷 | |
| D. | 用铜粉代替铜丝进行铜和浓硝酸反应的实验 |
| A. | 氯化锌溶液中投入钠 | B. | 氯化铁溶液中投入铜 | ||
| C. | 硝酸银溶液中投入铜 | D. | 硫酸铜溶液中投入铁 |
| A. | 某芳香烃的分子式为C10H14,它不能使溴水褪色,但可使酸性KMnO4溶液褪色,且分子结构中只有一个烷基,符合条件的烃有3种 | |
| B. | 按系统命名法,有机物  的命名为2,2,4,4,5-五甲基-3,3-二乙基己烷 的命名为2,2,4,4,5-五甲基-3,3-二乙基己烷 | |
| C. | 甲烷、甲醛、尿素都不存在同分异构体 | |
| D. | 某有机物含有C、H、O、N四种元素,其球棍模型为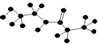 ,该有机物的结构简式为 ,该有机物的结构简式为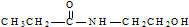 |
| A. | pH=a的醋酸溶液,稀释10倍后,其pH=b,则a=b-1 | |
| B. | 含等物质的量的NaHSO3和Na2SO3的溶液:2c(Na+)=3[c(HSO3-)+c(SO32-)+c(H2SO3)] | |
| C. | 0.1mol•L-1盐酸与0.2mol•L-1氨水等体积混合:c(NH3•H2O)>c(Cl-)>c(NH4+)>c(OH-) | |
| D. | 含有AgCl和AgI固体的悬浊液:c(Ag+)>c(Cl-)=c(I-) |
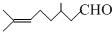 )是合成青蒿素原料之一.
)是合成青蒿素原料之一.