题目内容
5.某兴趣小组设计了如图所示原电池装置(盐桥中吸附有饱和K2SO4溶液).下列说法正确的是( )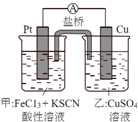
| A. | 该原电池的正极反应是Cu2++2e-=Cu | |
| B. | 甲烧杯中溶液的血红色逐渐变浅 | |
| C. | 盐桥中的SO42-流向甲烧杯 | |
| D. | 若将甲烧杯中的溶液换成稀硝酸,电流表指针反向偏转 |
分析 该原电池反应为Cu+2FeCl3═2FeCl2+CuCl2,则负极为Cu,发生Cu-2e-=Cu2+,阳离子移动到正极,左边烧杯中发生Fe3++e-═Fe2+,以此来解答.
解答 解:A.正极发生还原反应,为Fe3++e-═Fe2+,故A错误;
B.左边烧杯中发生Fe3++e-═Fe2+,则左烧杯中溶液的红色逐渐变浅,故B正确;
C.阴离子向负极移动,故C错误;
D.若将甲烧杯中的溶液换成稀硝酸,可氧化铜,铜为负极,电流表指针偏转方向不变,故D错误.
故选B.
点评 本题考查原电池,为高频考点,明确原电池反应及正、负极的判断、发生的电极反应是解答本题的关键,题目难度不大.

练习册系列答案
 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案 综合自测系列答案
综合自测系列答案
相关题目
15.化学是21世纪最富有创造性的中心学科•下列有关说法不正确的是( )
| A. | 按照规定对生活废弃物进行分类放置,实现资源再利用 | |
| B. | 防治环境污染、开发智能软件、合成新材料等,都属于化学研究的领域 | |
| C. | 利用人工光合成反应,将二氧化碳转化为碳氢化合物作燃料,属于低碳技术 | |
| D. | 液晶态介于晶体状态和液态之间,液晶具有有一定程度的晶体的有序性和液体的流动性 |
16.原子核外电子是分层排布的,在不同电子层上运动的电子的能量不同,下列电子层上运动的电子能量最高的是( )
| A. | K层 | B. | L层 | C. | M层 | D. | N层 |
13.下列说法正确的是( )
| A. | 蛋白质、淀粉和油脂都属于高分子化合物 | |
| B. | 人造纤维.合成纤维.碳纤维.光导纤维主要成分都是纤维素 | |
| C. | 误食重金属盐类时,可以喝大量牛奶、蛋清或豆浆解毒 | |
| D. | 福尔马林主要成分是甲酸,由于可使蛋白质变性,可用于保存动物标本 |
20.设NA为阿伏加德罗常数的值,下列叙述正确的是( )
| A. | 2.24LNH3和CH4的混合气体,所含电子总数为2NA | |
| B. | 1mol乙醇(CH3CH2OH)分子中含有共价键总数为8NA | |
| C. | 1mol/LNa2CO3溶液中,含有CO32-离子数为NA | |
| D. | 6.4gCu与足量浓硝酸反应,用排水法收集的气体分子数为0.2NA |
14.下列有关物质用途的说法不正确的是( )
| A. | 明矾可用作净水剂 | B. | 二氧化硫可用于熏蒸粉丝 | ||
| C. | 碳酸氢钠可用于治疗胃酸过多 | D. | 镁铝合金可用于制金属门窗 |
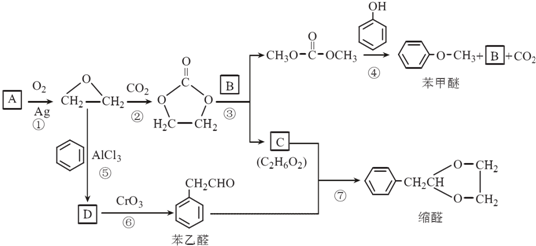
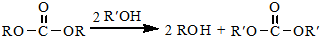
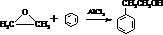 .
.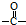 结构,核磁共振氢谱有4组峰,峰面积之比为3:2:2:1.
结构,核磁共振氢谱有4组峰,峰面积之比为3:2:2:1.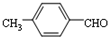 ,
,
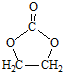 的合成路线,设计一条由2-氯丙烷和必要的无机试剂制备
的合成路线,设计一条由2-氯丙烷和必要的无机试剂制备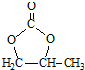 的合成路线(注明必要的反应条件).
的合成路线(注明必要的反应条件).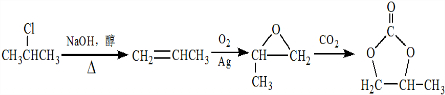 .
.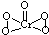 .
.