题目内容
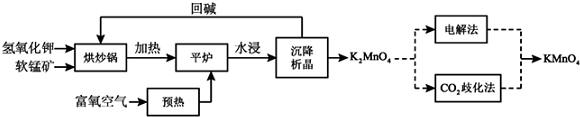
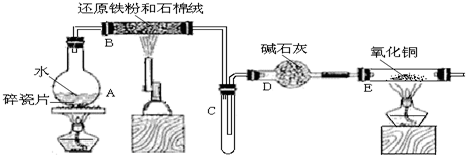
15.某探究性小组的同学设计实验探究铁与水蒸气的反应,并探究反应后生成物的一系列性质.(1)图为铁与水蒸气反应的实验装置,实验前应先检验装置的气密性,检验的方法为在a处连接导管并插入水中,用酒精灯对容器A进行微热,若导管口处有气泡产生,则确定装置的气密性良好.
(2)图1(Ⅰ)为产生水蒸气的装置,仪器A中除蒸馏水外,还需加入某种固体,其作用是防止暴沸.
(3)图1(Ⅱ)为铁与水蒸气反应的装置,写出硬质玻璃管B内所发生反应的化学方程式:3Fe+4H2O(g)$\frac{\underline{\;高温\;}}{\;}$Fe3O4+4H2.
(4)为检验硬质玻璃管B中反应后的气体产物是H2,还需从图2中选择必要的仪器和药品,设计出一套装置,其连接顺序为:a连j,f连b,c连h(填下列装置的接口字母).

分析 检查气密性可用微热法,即在在a处连接导管并插入水中,用酒精灯对容器A进行微热,观察导管口是否有气泡冒出.装置Ⅰ的目的是为反应提供水蒸气,为防止液体暴沸,应加入少量沸石或碎瓷片.硬质玻璃管中的反应为铁粉和水蒸气在高温条件下反应生成四氧化三铁和氢气.检验B中气体是否为氢气是用了氢气还原氧化铜的方法.为排除水蒸气的干扰,产生的气体先通过浓硫酸进行干燥,再与氧化铜反应,反应后观察氧化铜的颜色变化,并用无水硫酸铜检验生在的水,
(1)图甲为铁与水蒸气反应的实验装置,生成的水蒸气和铁在高温下反应需要装置气密性完好;
(2)装置Ⅰ的目的是为反应提供水蒸气,为防止液体暴沸,应加入少量沸石或碎瓷片;
(3)图甲I为产生水蒸气的装置,图甲II为铁与水蒸气反应的装置,硬质玻璃管B内所发生反应是铁和水蒸气反应生成四氧化三铁和氢气;
(4)为了验证硬质玻璃管B中反应后的气体产物是H2,同时含有水蒸气,需要通过装置中的浓硫酸干燥氢气,然后通过装置中的氧化铜发生氧化还原反应生成红色铜和水蒸气,通过无水硫酸铜检验生成的水蒸气存在,最后需要剩余氢气的处理.
解答 解:(1)铁与水蒸气反应的实验装置分析可知,装置中A需要生成水蒸气,通入B中和铁在高温下反应所以需要装置气密性完好,检验的方法为:在a处连接导管并插入水中,用酒精灯对容器A进行微热,若导管口处有气泡产生,则确定装置的气密性良好,
故答案为:在a处连接导管并插入水中,用酒精灯对容器A进行微热,若导管口处有气泡产生,则确定装置的气密性良好;
(2)图1(Ⅰ)为产生水蒸气的装置,仪器A中除蒸馏水外,还需加入某种固体,为防止液体暴沸,应加入少量沸石或碎瓷片.
故答案为:防止暴沸;
(3)图甲I为产生水蒸气的装置,图甲II为铁与水蒸气反应的装置,硬质玻璃管B内所发生反应是铁和水蒸气反应生成四氧化三铁和氢气,反应的化学方程式为:3Fe+4H2O$\frac{\underline{\;高温\;}}{\;}$Fe3O4+4H2,
故答案为:3Fe+4H2O(g)$\frac{\underline{\;高温\;}}{\;}$Fe3O4+4H2 ;
(4)硬质玻璃管B中反应后的气体产物是H2,同时含有水蒸气,需要通过装置中的浓硫酸干燥氢气,然后通过装置中的氧化铜发生氧化还原反应生成红色铜和水蒸气,通过无水硫酸铜检验生成的水蒸气存在,最后需要剩余氢气的处理,为了验证硬质玻璃管B中反应后的气体产物是H2,其连接顺序为ajfbch,
故答案为:j;f;b;c;h.
点评 本题考查了物质制备、物质性质、反应产物的实验验证等知识点,掌握基础是解题关键,题目难度中等.

| A. | Na+、Cu2+、Cl-、SO42- | B. | Na+、HCO3-、Cl-、NO3- | ||
| C. | Na+、SO32-、NO3-、K+ | D. | K+、SO42-、Mg2+、Cl- |
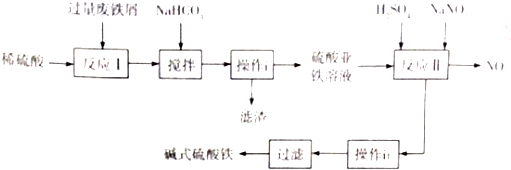
已知:
| 沉淀物 | Fe(OH)3 | Fe(OH)3 | Al(OH)3 |
| 开始沉淀的pH | 2.3 | 7.5 | 3.4 |
| 完全沉淀的pH | 3.2 | 9.7 | 4.4 |
(1)写出反应I中主反应的离子方程式:Fe+2H+═Fe2++H2↑.
(2)加入NaHCO3,调节溶液pH=4.4~5.5,目的是使A13+转化为沉淀除去.
(3)操作i的名称是过滤,滤渣的成分是Al(OH)3、Fe.
(4)反应II的氧化剂与还原剂的物质的最之比为1:1,该反应的还原产物的化学式为NO.
(5)Fe(OH)SO4溶于水后生成Fe(OH)2+,该离子部分水解,生成Fe2(OH)42+.该水解反应的离子方程式为2Fe(OH)2++2H2O?Fe2(OH)42++2H+.
| A. | Na2O2与Na2O | B. | Na2O2 | C. | Na2O2与Na | D. | Na和Na2O |
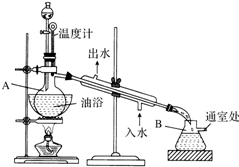 乙酸乙酯是无色的有水果香味的液体,沸点77.1℃,某次制取实验用到冰醋酸14.3mL,95%乙醇23mL,还用到浓H2SO4,饱和Na2CO3溶液以及极易与乙醇结合成六醇合物的氯化钙溶液,主要仪器装置如图所示,实验步骤是:
乙酸乙酯是无色的有水果香味的液体,沸点77.1℃,某次制取实验用到冰醋酸14.3mL,95%乙醇23mL,还用到浓H2SO4,饱和Na2CO3溶液以及极易与乙醇结合成六醇合物的氯化钙溶液,主要仪器装置如图所示,实验步骤是: