题目内容
下列实验现象,与新制氯水中的某些成分(括号内物质)没有关系的是( )
| A、使红色布条退色(HCl) |
| B、滴加AgNO3溶液生成白色沉淀(Cl-) |
| C、将NaHCO3固体加入新制氯水中,有无色气泡(H+) |
| D、向FeCl2溶液中滴加氯水,再滴加KSCN溶液,发现呈红色(Cl2) |
考点:氯气的化学性质
专题:
分析:氯气与水反应,发生Cl2+H2O=H++Cl-+HClO,氯水中含有HClO、Cl2,具有氧化性,其中HClO具有漂白性,含有H+,具有酸性,以此解答.
解答:
解:A.次氯酸具有强氧化性,能氧化有色布条,故A选;
B.氯离子和硝酸银反应生成氯化银白色沉淀,故B不选;
C.氯水显酸性,能与碳酸氢钠反应生成CO2气体,故C不选;
D.是氯气氧化了亚铁离子生成三价铁,再滴加KSCN溶液,发现呈红色,故D不选.
故选A.
B.氯离子和硝酸银反应生成氯化银白色沉淀,故B不选;
C.氯水显酸性,能与碳酸氢钠反应生成CO2气体,故C不选;
D.是氯气氧化了亚铁离子生成三价铁,再滴加KSCN溶液,发现呈红色,故D不选.
故选A.
点评:本题考查氯气的性质,侧重于氯水的组成和性质的考查,为高频考点,难度大不,注意把握相关物质的性质.

练习册系列答案
相关题目
如图所示,两个连通容器用活塞分开,左室容积为右室的两倍,但温度相同,现分别按如图所示的量充入气体,加入少量固体催化剂使左右两室内气体充分反应达到平衡,打开活塞,继续反应再次达到平衡,下列有关判断正确的是( )
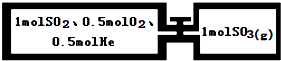

| A、通入气体未反应前,左室压强比右室大 |
| B、第一次平衡时,左室内压强一定小于右室 |
| C、第一次平衡时,SO2的物质的量右室更多 |
| D、第二次平衡时,SO2的总物质的量比第一次平衡时左室SO2的物质的量的2倍多 |
下列说法正确的是( )
| A、常温下,在0.1mol/LNaOH溶液和0.1mol/L盐酸中水的离子积相等 |
| B、常温下,在水中加入NaOH,水的电离受到抑制,水的离子积减小 |
| C、HCl溶液中无OH-,NaOH溶液中无H+,NaCl溶液中既无OH-也无H+ |
| D、在水溶液中导电能力强的电解质是强电解质,导电能力弱的电解质是弱电解质 |
小红中午放学回家后,妈妈在高压锅内做了她最爱吃的鸡肉请问高压锅是下列什么合金制造的( )
| A、锰合金 | B、铝合金 |
| C、镍合金 | D、铁合金 |
下列垃圾中,不适合用卫生填埋、焚烧、堆肥等处理方法处理的是( )
| A、电池 | B、农用塑料薄膜 |
| C、卫生纸 | D、纯棉纺织品 |
下列离子在溶液中,因发生氧化还原反应而不能大量共存的是( )
| A、H+、Na+、CO32-、SO42- |
| B、H+、Fe3+、Cl-、I- |
| C、NH4+、Ba2+、SO42-、NO3- |
| D、Na+、K+、MnO4-、Cl- |
下列说法正确的是( )
| A、不溶于水的物质的溶解度为0 |
| B、H+与OH-在水溶液中混合时,反应的活化能几乎为0 |
| C、对已达平衡的可逆反应,v(正)=v(逆)=0 |
| D、常温下,1mol/L的CH3COOH溶液,pH=0 |
下列选项中,与物质体积大小无关的因素是( )
| A、粒子数目 |
| B、粒子大小 |
| C、粒子之间的距离 |
| D、粒子的化学性质 |
某合金是由锌铁按照一定比例熔合而成,其中锌的质量分数为72%.某同学取0.1g该合金粉末进行实验,则所取样品所含铁原子数约为( )
| A、3.01×1020个 |
| B、6.02×1021个 |
| C、7.74×1020个 |
| D、6.67×1020个 |