题目内容
有66.4gKClO3和MnO2的混合物,加热一段时间后,质量变为56.8g,将此剩余固体平均分为两份.
(1)一份加足量水溶解后,过滤,在滤液中加足量的硝酸酸化了的AgNO3溶液,可得沉淀多少克?
(2)另一份加足量的浓盐酸,加热使之充分反应,将放出的气体通入含有KI、KBr的1L混合溶液中,恰好使溶液中的Br-、I-完全反应.若c(KI)=c(KBr)=0.4 mol?L-1,求:原混合物中KClO3的物质的量.(已知:KClO3与浓盐酸反应生成KCl、CL2和H2O)
(1)一份加足量水溶解后,过滤,在滤液中加足量的硝酸酸化了的AgNO3溶液,可得沉淀多少克?
(2)另一份加足量的浓盐酸,加热使之充分反应,将放出的气体通入含有KI、KBr的1L混合溶液中,恰好使溶液中的Br-、I-完全反应.若c(KI)=c(KBr)=0.4 mol?L-1,求:原混合物中KClO3的物质的量.(已知:KClO3与浓盐酸反应生成KCl、CL2和H2O)
考点:化学方程式的有关计算
专题:计算题
分析:(1)发生反应:2KClO3
2KCl+3O2↑,根据差量法计算生成KCl的质量,进而计算每一份中KCl的物质的量,根据氯离子守恒n(AgCl)=n(KCl),再根据m=nM计算氯化银的质量;
(2)根据Br-、I-的物质的量,计算生成氯气的物质的量,加入盐酸发生反应:KClO3+6HCl=KCl+3Cl2↑+3H2O,MnO2+4HCl(浓)
MnCl2+Cl2↑+2H2O,令每一份中剩余KClO3、MnO2的物质的量分别为xmol、ymol,根据方程式表示氯气的物质的量,根据氯气物质的量列方程,计算每一份分解的KClO3的物质的量,再根据总质量列方程,联立方程计算解答.
| ||
| △ |
(2)根据Br-、I-的物质的量,计算生成氯气的物质的量,加入盐酸发生反应:KClO3+6HCl=KCl+3Cl2↑+3H2O,MnO2+4HCl(浓)
| ||
解答:
解:(1)设生成KCl的质量为m,则:
2KClO3
2KCl+3O2↑ 固体质量减少
149g 96g
m 66.4g-56.8g=9.6g
故m=
=14.9g,
故每一份中生成KCl的质量为
=7.45g,其物质的量=
=0.1mol,
根据氯离子守恒n(AgCl)=n(KCl)=0.1mol,故m(AgCl)=0.1mol×143.5g/mol=14.35g,
答:生成沉淀的质量为14.35g.
(2)n(KI)=n(KBr)=1L×0.4 mol?L-1=0.4mol,根据电子转移n(Cl2)=
=0.4mol,
令每一份中剩余KClO3、MnO2的物质的量分别为xmol、ymol,则:
KClO3+6HCl=KCl+3Cl2↑+3H2O
xmol 3xmol
MnO2+4HCl(浓)
MnCl2+Cl2↑+2H2O,
ymol ymol
所以3x+y=0.4,
由(1)中KCl的物质的量,根据Cl原子守恒,可知每一份中分解KClO3的物质的量为0.1mol,则原混合物中KClO3的物质的量为2(x+0.1)mol,MnO2的物质的量分别为2ymol,则:
2(x+0.1)×122.5+2y×87=66.4,
联立方程解得:x=0.1 y=0.1,
故原混合物中KClO3的物质的量为2(x+0.1)mol=2×(0.1+0.1)mol=0.4mol,
答:原混合物中KClO3的物质的量为0.4mol.
2KClO3
| ||
| △ |
149g 96g
m 66.4g-56.8g=9.6g
故m=
| 149g×9.6g |
| 96g |
故每一份中生成KCl的质量为
| 14.9g |
| 2 |
| 7.45g |
| 74.5g/mol |
根据氯离子守恒n(AgCl)=n(KCl)=0.1mol,故m(AgCl)=0.1mol×143.5g/mol=14.35g,
答:生成沉淀的质量为14.35g.
(2)n(KI)=n(KBr)=1L×0.4 mol?L-1=0.4mol,根据电子转移n(Cl2)=
| 0.4mol×1+0.4mol×1 |
| 2 |
令每一份中剩余KClO3、MnO2的物质的量分别为xmol、ymol,则:
KClO3+6HCl=KCl+3Cl2↑+3H2O
xmol 3xmol
MnO2+4HCl(浓)
| ||
ymol ymol
所以3x+y=0.4,
由(1)中KCl的物质的量,根据Cl原子守恒,可知每一份中分解KClO3的物质的量为0.1mol,则原混合物中KClO3的物质的量为2(x+0.1)mol,MnO2的物质的量分别为2ymol,则:
2(x+0.1)×122.5+2y×87=66.4,
联立方程解得:x=0.1 y=0.1,
故原混合物中KClO3的物质的量为2(x+0.1)mol=2×(0.1+0.1)mol=0.4mol,
答:原混合物中KClO3的物质的量为0.4mol.
点评:本题考查化学方程式计算,明确发生的反应是关键,侧重考查学生分析能力、计算能力,注意根据方程式解答.

练习册系列答案
相关题目
下列各组中的两种物质作用,反应条件(温度或者反应物用量)改变,不会引起产物种类改变的是( )
| A、Na和O2 |
| B、NaOH和CO2 |
| C、NaAlO2和盐酸 |
| D、AlCl3和氨水 |
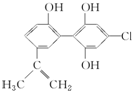 禁止运动员使用兴奋剂是保证比赛公平、公正的重要举措之一.其中一种兴奋剂X的结构如图所示.下列说法不正确的是( )
禁止运动员使用兴奋剂是保证比赛公平、公正的重要举措之一.其中一种兴奋剂X的结构如图所示.下列说法不正确的是( )| A、1 mol X与足量NaOH溶液反应,最多消耗3 mol NaOH |
| B、1 mol X与足量浓溴水反应,最多消耗4 mol Br2 |
| C、X遇FeCl3溶液显色,可看作酚类物质 |
| D、兴奋剂X所有碳原子有可能共平面 |
 随着科学技术的发展,阿佛加德罗常数的测定手段越来越多,测定的精度也越来越高.现有一种简单可行的测定方法,具体步骤为:
随着科学技术的发展,阿佛加德罗常数的测定手段越来越多,测定的精度也越来越高.现有一种简单可行的测定方法,具体步骤为: 用50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:
用50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题: