题目内容
19. 下图是盐酸与氢氧化钠溶液的滴定曲线a和b.
下图是盐酸与氢氧化钠溶液的滴定曲线a和b.试认真分析后填空:
(1)曲线a是用NaOH滴定HCl;
曲线b是用HCl滴定NaOH.
(2)P点的纵坐标为P(15,7).
(3)盐酸的物质的量浓度为0.1mol•L-1;氢氧化钠溶液的体积为15mL.
分析 (1)根据曲线a的pH的变化趋势来判断;
(2)根据曲线P点时pH值为7,此时氢离子和氢氧根离子的物质的量是相等的;
(3)根据曲线a可以看出盐酸溶液的pH=1,然后求出盐酸的物质的量浓度;
解答 解:(1)曲线a的pH是由小到大,说明是氢氧化钠溶液滴定盐酸溶液的曲线,曲线b的pH是由大到小,说明是盐酸溶液滴定氢氧化钠溶液的曲线,
故答案为:NaOH;HCl;HCl;NaOH;
(2)根据图示,可以知道盐酸的浓度和氢氧化钠的浓度是相等的,都是0.1mol/L,曲线P点时pH值为7,此时氢离子和氢氧根离子的物质的量是相等的,氢氧化钠的体积是15,所以盐酸的体积也是15mL,即P的坐标是(15,7),
故答案为:P(15,7);
(3)根据曲线的起点可以看出盐酸溶液的pH=1,pH=-lgc(H+)=1,所以c(HCl)=c(H+)=0.1mol/L,根据曲线的起点可以看出氢氧化钠溶液的pH=13,所以氢氧化钠的浓度为0.1mol/L,所以根据坐标可知,氢氧化钠的体积为15mL时,酸碱恰好完全反应,
故答案为:0.1;15.
点评 本题借助于滴定曲线考查了中和滴定过程中PH的变化,难度不大,关键能从图中要得出信息.

练习册系列答案
 轻松暑假总复习系列答案
轻松暑假总复习系列答案
相关题目
7.下列反应的生成物为纯净物的是( )
| A. | CH4与Cl2光照 | B. | 乙烯在催化剂的作用下生成聚乙烯 | ||
| C. | 乙烯和氯化氢加成 | D. | 新戊烷和Cl2光照 |
14.下列因素中一定能引起平衡移动的是( )
| A. | 催化剂 | B. | 温度 | C. | 浓度 | D. | 压强 |
8.某工厂排放的废液中含有少量硫酸和硫酸铜,小军同学取适量废液放入盛有一定量锌粉的烧杯中,搅拌,待充分反应后过滤,得少量滤渣和滤液,关于该实验,下列说法正确的是( )
| A. | 发生的反应都是置换反应 | B. | 实验所得滤液是纯水,可直接排放 | ||
| C. | 滤渣中一定含铜和锌 | D. | 反应前后液体的酸性减弱,pH变小 |
9.由CO2、CO和H2组成的混合气体在同温同压下与氮气的密度相同,则该混合气体中CO2、CO和H2的体积比为( )
| A. | 29:13:8 | B. | 13:29:8 | C. | 22:14:1 | D. | 26:57:15 |
 利用I2O5可消除CO污染或定量测定CO,反应为:
利用I2O5可消除CO污染或定量测定CO,反应为:

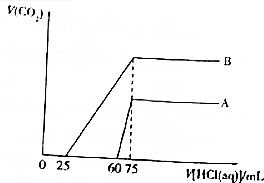 取等物质的量浓度的NaOH溶液两份A和B,每份50mL,向其中各通入一定量的CO2,然后各取溶液10mL,分别将其稀释为100mL,再分别向稀释后的溶液中逐滴加入0.1mol•L-1的盐酸,标准状况下产生CO2气体体积与所加盐酸体积之间的关系如图所示.
取等物质的量浓度的NaOH溶液两份A和B,每份50mL,向其中各通入一定量的CO2,然后各取溶液10mL,分别将其稀释为100mL,再分别向稀释后的溶液中逐滴加入0.1mol•L-1的盐酸,标准状况下产生CO2气体体积与所加盐酸体积之间的关系如图所示.