题目内容
13.ClO2是一种消毒杀菌效率高、二次污染小的水处理剂.实验室可通过以下反应制得ClO2:2KClO3+H2C2O4+H2SO═2ClO2↑+K2SO4+2CO2↑+2H2O 下列说法不正确的是( )| A. | KClO3在反应中得到电子 | |
| B. | ClO2是还原产物 | |
| C. | H2C2O4在反应中被还原 | |
| D. | 1mol H2C2O4参加反应有2mol电子转移 |
分析 反应2KClO3+H2C2O4+H2SO4=2ClO2↑+K2SO4+2CO2↑+2H2O 中,Cl元素的化合价由+5降低为+4价,C元素的化合价由+3升高到+4价,以此来解答.
解答 解:A.因反应中Cl元素的化合价由+5降低为+4价,则KClO3在反应中得到电子,故A正确;
B.Cl元素的化合价降低,被还原,对应的产物为还原产物,即ClO2是还原产物,故B正确;
C.因C元素的化合价由+3升高到+4价,则H2C2O4在反应中作还原剂,被氧化,故C错误;
D.Cl元素的化合价由+5降低为+4价,1molKClO3参加反应转移的电子为1mol×(5-4)=1mol,故D错误;
故选CD.
点评 本题考查氧化还原反应,为高频考点,把握反应中元素的化合价变化及基本概念为解答的关键,侧重分析与应用能力的考查,题目难度不大.

练习册系列答案
 字词句段篇系列答案
字词句段篇系列答案
相关题目
4.下列叙述中正确的( )
| A. | 阳离子不一定是金属离子,含阳离子的物质一定含阴离子 | |
| B. | 阴、阳离子相互反应不一定形成离子化合物 | |
| C. | 共价化合物均属于弱电解质 | |
| D. | 由某金属元素的阳离子和某非金属元素阴离子组成的物质一定是纯净物 |
1.设v正和v逆分别表示可逆反应的正反应速率和逆反应速率.在一定温度下逆反应N2+3H2$?_{催化剂}^{高温、高压}$2NH3达到平衡时( )
| A. | 各物质的量浓度保持不变 | B. | 各物质的量浓度相等 | ||
| C. | V逆=V正,正逆反应停止 | D. | N2、H2、NH3的速率相等 |
18.下列实验误差分析错误的是( )
| A. | 用润湿的pH试纸测稀碱溶液的pH,测定值偏小 | |
| B. | 用容量瓶配制溶液,定容时俯视刻度线,所配溶液浓度偏小 | |
| C. | 用标准液滴定待测液,滴定前滴定管内无气泡,终点读数时有气泡,所测体积偏小 | |
| D. | 中和热测定实验中,将碱缓慢倒入酸中,所测温度值偏小 |
5.对于反应:2SO2(g)+O2(g)?2SO3(g)+Q(Q>0),达到平衡后,改变一个条件,以下有关分析正确的是( )
| A. | 升高温度,正反应速率增大,化学平衡常数增大 | |
| B. | 减小压强,逆反应速率减小,化学平衡常数减小 | |
| C. | 加入催化剂,正逆反应速率不变,平衡不移动 | |
| D. | 充入氧气,正反应速率先增大后减小,平衡向正反应方向移动 |
2.碳和氮是动植物体中的重要组成元素,向大气中过度排放二氧化碳会造成温室效应,氮氧化物会产生光化学烟雾,目前,这些有毒有害气体的处理成为科学研究的重要内容.
(1)用活性炭还原法处理氮氧化物.有关反应为:C(s)+2NO(g)?N2(g)+CO2(g).
某研究小组向一个容器容积为3L且容积不变的密闭真空容器(固体试样体积忽略不计)中加入NO和足量的活性炭,在恒温(T1℃)条件下反应,测得不同时间(t)时各物质的物质的量(n)如表:
①根据表中数据,计算T1℃时该反应的平衡常数为0.56(保留两位小数).若某一时刻,容器中有1.2molC、1.2molNO、0.75molN2和1.08molCO2,此时v(正)=v(逆)(填“>、<、=”)
②下列各项能判断该反应达到平衡状态的是AC(填序号字母).
A.v(NO)(正)=2v(N2)(逆) B.容器内CO2和N2的体积比为1:1
C.混合气体的平均相对分子质量保持不变 D.容器内压强保持不变
③一定温度下,随着NO的起始浓度增大,则NO的平衡转化率不变(填“增大”、“不变”或“减小”).
(2)在3L容积可变的密闭容器中发生上述反应:H2(g)+CO2(g)?H2O(g)+CO(g),恒温下c(CO)随反应时间t变化的曲线Ⅰ如图1所示.
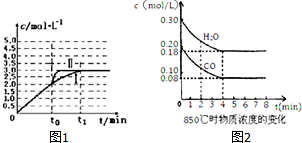
①若在t0时改变一个条件,使曲线Ⅰ变成曲线Ⅱ,则改变的条件是加入催化剂;
②若在t0时刻将容器体积快速压缩至2L(其他条件不变),请在图中画出c(CO)随反应时间t变化的曲线.
(3)已知:CO(g)+H2O(g)?H2(g)+CO2(g)△H=-41.2kJ/mol,850℃时在一体积为10L的恒容密闭容器中,通入一定量的CO和H2O,CO和H2O浓度变化如图2所示:下列说法正确的是C(填序号)
A.达到平衡时,氢气的物质的量是0.12mol
B.达到平衡时,反应体系最终会放出49.44kJ热量
C.第6min时,若升高温度,反应平衡常数会减小
D.第8min时,若充入氦气,会导致v正(CO)<v逆(H2O)
(4)850℃时,若在容积为2L的密闭容器中同时充入1.0mol CO,3.0mol H2O,amol CO2和bmol H2.若达平衡时各组分体积分数都与(3)中平衡时相同,则a=3mol,b=3mol.
(1)用活性炭还原法处理氮氧化物.有关反应为:C(s)+2NO(g)?N2(g)+CO2(g).
某研究小组向一个容器容积为3L且容积不变的密闭真空容器(固体试样体积忽略不计)中加入NO和足量的活性炭,在恒温(T1℃)条件下反应,测得不同时间(t)时各物质的物质的量(n)如表:
| n/mol t/min | NO | N2 | CO2 |
| 0 | 2.00 | 0 | 0 |
| 10 | 1.16 | 0.42 | 0.42 |
| 20 | 0.80 | 0.60 | 0.60 |
| 30 | 0.80 | 0.60 | 0.60 |
②下列各项能判断该反应达到平衡状态的是AC(填序号字母).
A.v(NO)(正)=2v(N2)(逆) B.容器内CO2和N2的体积比为1:1
C.混合气体的平均相对分子质量保持不变 D.容器内压强保持不变
③一定温度下,随着NO的起始浓度增大,则NO的平衡转化率不变(填“增大”、“不变”或“减小”).
(2)在3L容积可变的密闭容器中发生上述反应:H2(g)+CO2(g)?H2O(g)+CO(g),恒温下c(CO)随反应时间t变化的曲线Ⅰ如图1所示.

①若在t0时改变一个条件,使曲线Ⅰ变成曲线Ⅱ,则改变的条件是加入催化剂;
②若在t0时刻将容器体积快速压缩至2L(其他条件不变),请在图中画出c(CO)随反应时间t变化的曲线.
(3)已知:CO(g)+H2O(g)?H2(g)+CO2(g)△H=-41.2kJ/mol,850℃时在一体积为10L的恒容密闭容器中,通入一定量的CO和H2O,CO和H2O浓度变化如图2所示:下列说法正确的是C(填序号)
A.达到平衡时,氢气的物质的量是0.12mol
B.达到平衡时,反应体系最终会放出49.44kJ热量
C.第6min时,若升高温度,反应平衡常数会减小
D.第8min时,若充入氦气,会导致v正(CO)<v逆(H2O)
(4)850℃时,若在容积为2L的密闭容器中同时充入1.0mol CO,3.0mol H2O,amol CO2和bmol H2.若达平衡时各组分体积分数都与(3)中平衡时相同,则a=3mol,b=3mol.
3.组成和结构可用 表示的有机物共有(不考虑立体异构体)( )
表示的有机物共有(不考虑立体异构体)( )
 表示的有机物共有(不考虑立体异构体)( )
表示的有机物共有(不考虑立体异构体)( )| A. | 12 种 | B. | 24 种 | C. | 36 种 | D. | 40 种 |