题目内容
 用如图所示装置进行中和热测定实验,请回答下列问题:
用如图所示装置进行中和热测定实验,请回答下列问题:(1)大小烧杯之间填满碎泡沫塑料的作用是
(2)使用补全仪器后的装置进行实验,取50mL 0.25mol/L H2SO4溶液与50mL 0.55mol/L NaOH溶液在小烧杯中进行中和反应,实验中若用60mL 0.25mol?L-1 H2SO4溶液跟50mL 0.55mol?L-1 NaOH溶液进行反应,与上述实验相比,所求中和热
考点:中和热的测定
专题:实验题
分析:(1)中和热测定实验成败的关键是保温工作;根据量热计的构造来判断该装置的缺少仪器;
(2)中和热的均是强酸和强碱反应生成1mol水时放出的热,和所用酸以及碱的量的多少无关;根据弱电解质的电离时吸热过程.
(2)中和热的均是强酸和强碱反应生成1mol水时放出的热,和所用酸以及碱的量的多少无关;根据弱电解质的电离时吸热过程.
解答:
解:(1)中和热测定实验成败的关键是保温工作,大小烧杯之间填满碎泡沫塑料的作用是保温、隔热、减少实验过程中的热量损失;由量热计的构造可知该装置的缺少仪器是环形玻璃搅拌棒;
故答案为:保温、隔热、减少实验过程中的热量损失;环形玻璃搅拌棒;
(2)若用60mL 0.25mol?L-1 H2SO4溶液跟50mL 0.55mol?L-1 NaOH溶液进行反应,与上述实验相比,生成水的量增多,所放出的热量偏高,但是中和热的均是强酸和强碱反应生成1mol水时放出的热,中和热相等;
醋酸是弱酸,电离过程吸热,所以用50mL0.50mol?L-1醋酸代替H2SO4溶液进行上述实验,测得反应前后温度的变化值会减小,
故答案为:相等;偏小.
故答案为:保温、隔热、减少实验过程中的热量损失;环形玻璃搅拌棒;
(2)若用60mL 0.25mol?L-1 H2SO4溶液跟50mL 0.55mol?L-1 NaOH溶液进行反应,与上述实验相比,生成水的量增多,所放出的热量偏高,但是中和热的均是强酸和强碱反应生成1mol水时放出的热,中和热相等;
醋酸是弱酸,电离过程吸热,所以用50mL0.50mol?L-1醋酸代替H2SO4溶液进行上述实验,测得反应前后温度的变化值会减小,
故答案为:相等;偏小.
点评:本题考查学生有关中和热的测定知识,注意理解中和热的概念是解题的关键,难度不大.

练习册系列答案
相关题目
在25℃时,物质的浓度相等的NH4Cl、CH3COONH4、NH4HSO4的溶液中,其对应溶液中NH4+的物质的量浓度分别为a、b、c(单位为mol?L-1),下列判断正确的是( )
| A、a=b=c |
| B、a=c>b |
| C、b>a>c |
| D、c>a>b |
下列有关阿伏伽德罗常数说法正确的是( )
| A、含0.2mol H2SO4的浓硫酸与足量锌反应,生成气体的分子数小于0.1NA |
| B、标况下,22.4L四氯化碳所含分子数大于NA |
| C、0.1mol/L的AgNO3溶液中,阳离子所带正电荷数目为0.1NA |
| D、0.2mol/L的H2SO4的硫酸溶液与0.1mol/L的H2SO4的硫酸溶液等质量混合溶液浓度大于0.15mol/L |
 ,芳香烃A能发生如图一系列转化:
,芳香烃A能发生如图一系列转化:
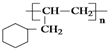 的线路.(用A→…→目标产物 在箭号上写明反应试剂及反应条件.)
的线路.(用A→…→目标产物 在箭号上写明反应试剂及反应条件.)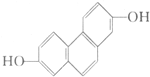 质子核磁共振谱是研究有机化合物结构的有力手段之一.结构中的等效氢原子核磁共振谱中都给出了相应的峰值 (信号),谱中峰的强度与结构中的H原子数成正比.试回答,结构简式为如图所示的有机化合物:
质子核磁共振谱是研究有机化合物结构的有力手段之一.结构中的等效氢原子核磁共振谱中都给出了相应的峰值 (信号),谱中峰的强度与结构中的H原子数成正比.试回答,结构简式为如图所示的有机化合物: