题目内容
I:室温下某金属为液态,当用惰性电极电解它的一价金属的硝酸盐溶液时,阴极得到的产物是该金属的单质.当阴极消耗2mol该盐的阳离子时,阳极可得1mol的气体产物,由此可推断得知该盐的化学式是 ;
II:已知反应①是用惰性电极电解下发生的,B,D均是常见金属单质,E为常见非金属单质,H常温下为无色液体.反应②在催化剂和加热条件下进行,是工业上制取C的反应之一.根据下列关系,试回答:
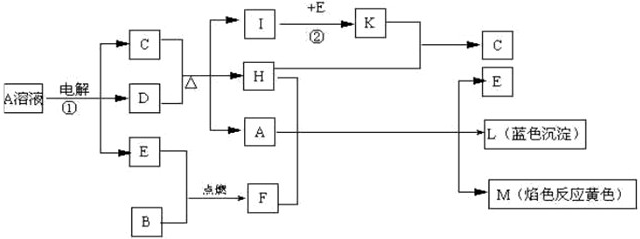
(1)E的化学式:
(2)反应①的离子方程式: .
(3)反应②每生成1molK,放出98.3kJ热量,该反应的热化学方程式为:(其中方程式里I系数为1) .
II:已知反应①是用惰性电极电解下发生的,B,D均是常见金属单质,E为常见非金属单质,H常温下为无色液体.反应②在催化剂和加热条件下进行,是工业上制取C的反应之一.根据下列关系,试回答:

(1)E的化学式:
(2)反应①的离子方程式:
(3)反应②每生成1molK,放出98.3kJ热量,该反应的热化学方程式为:(其中方程式里I系数为1)
考点:电解原理,无机物的推断
专题:推断题,电化学专题
分析:Ⅰ、用惰性电极电解汞的硝酸盐溶液时,根据两极上的反应结合电子守恒来确定Hg的化合价,进而确定其化学式;
Ⅱ、(1)A的电解产物反应生成H,H常温下为无色液体,H为H2O;L是蓝色沉淀,为Cu(OH)2,M的焰色反应为黄色,M含有Na元素,由转化关系A+H+F→E+L+M,即A溶液+F→E+L+M,可知F与水反应生成碱与E,且B+E→F,故F为Na2O2,E为O2,B为金属Na,A为铜盐,由A溶液
C+D+E可知,电解产物为三种,为放氧生酸型,电解生成Cu、O2、酸,C的浓溶液在加热时与D反应,D为Cu,C为H2SO4,故A为CuSO4,由C+D
I+D+H可知,I为SO2,由I
K可知,K为SO3,SO3与水反应生成硫酸,验证符合转化关系;
(2)根据电解池的工作原理以及电解方程式的书写方法来书写;
(3)根据热化学方程式的书写方法以及其意义知识来回答.
Ⅱ、(1)A的电解产物反应生成H,H常温下为无色液体,H为H2O;L是蓝色沉淀,为Cu(OH)2,M的焰色反应为黄色,M含有Na元素,由转化关系A+H+F→E+L+M,即A溶液+F→E+L+M,可知F与水反应生成碱与E,且B+E→F,故F为Na2O2,E为O2,B为金属Na,A为铜盐,由A溶液
| ||
| △ |
| E |
(2)根据电解池的工作原理以及电解方程式的书写方法来书写;
(3)根据热化学方程式的书写方法以及其意义知识来回答.
解答:
解:I:室温只有下Hg金属为液态,用惰性电极电解汞的硝酸盐溶液时,阳极上发生的电极反应式为:4OH-=4e-+O2↑+2H2O,设盐中Hg的化合价是+x,则阴极上的电极反应为:Hgx++xe-=Hg,当阴极消耗2mol该盐的阳离子时,转移电子是2x,此时阳极可得1mol的气体产物,即0.5x=1,所以x=2,即该盐的化学式为Hg(NO3)2,故答案为:Hg(NO3)2;
Ⅱ:(1)A的电解产物反应生成H,H常温下为无色液体,H为H2O;L是蓝色沉淀,为Cu(OH)2,M的焰色反应为黄色,M含有Na元素,由转化关系A+H+F→E+L+M,即A溶液+F→E+L+M,可知F与水反应生成碱与E,且B+E→F,故F为Na2O2,E为O2,B为金属Na,A为铜盐,由A溶液
C+D+E可知,电解产物为三种,为放氧生酸型,电解生成Cu、O2、酸,C的浓溶液在加热时与D反应,D为Cu,C为H2SO4,故A为CuSO4,由C+D
I+D+H可知,I为SO2,由I
K可知,K为SO3,SO3与水反应生成硫酸,验证符合转化关系,故答案为:O2;
(2)反应①为电解硫酸铜溶液生成铜、硫酸、氧气,反应离子方程式为:2Cu2++2H2O
2Cu+O2↑+4H+,
故答案为:2Cu2++2H2O
2Cu+O2↑+4H+;
(3)每生成1molK为SO3,反应放出98.3kJ热量,该反应的热化学方程式为:SO2(g)+
O2(g)?SO3(g)△H=-98.3kJ/mol,
故答案为:SO2(g)+
O2(g)?SO3(g)△H=-98.3kJ/mol.
Ⅱ:(1)A的电解产物反应生成H,H常温下为无色液体,H为H2O;L是蓝色沉淀,为Cu(OH)2,M的焰色反应为黄色,M含有Na元素,由转化关系A+H+F→E+L+M,即A溶液+F→E+L+M,可知F与水反应生成碱与E,且B+E→F,故F为Na2O2,E为O2,B为金属Na,A为铜盐,由A溶液
| ||
| △ |
| E |
(2)反应①为电解硫酸铜溶液生成铜、硫酸、氧气,反应离子方程式为:2Cu2++2H2O
| ||
故答案为:2Cu2++2H2O
| ||
(3)每生成1molK为SO3,反应放出98.3kJ热量,该反应的热化学方程式为:SO2(g)+
| 1 |
| 2 |
故答案为:SO2(g)+
| 1 |
| 2 |
点评:本题以无机框图题的形式考查Na、S、Cu等元素单质及其化合物之间的相互转化关系和逻辑推理能力、化学用语的书写、硫酸工业等,本题中L是蓝色沉淀,M的焰色反应为黄色,H常温下为无色液体以及A的电解等为解题突破口,根据L、M推断出F、E,再利用倒推法与顺推法向结合推断,对学生的逻辑推理能力提出较高要求,题目难度较大.

练习册系列答案
相关题目
0.1mol阿斯匹林(其学名为乙酰水杨酸,结构简式为 与足量的NaOH溶液反应,最多消耗NaOH的物质的量( )
与足量的NaOH溶液反应,最多消耗NaOH的物质的量( )
 与足量的NaOH溶液反应,最多消耗NaOH的物质的量( )
与足量的NaOH溶液反应,最多消耗NaOH的物质的量( )| A、0.1mol |
| B、0.2mol |
| C、0.3mol |
| D、0.4mol |
下列物质中,属于非电解质的是( )
| A、食盐 | B、盐酸 | C、蔗糖 | D、磷酸钠 |
 如图是茉莉酮酸酯的结构简式,有关该物质的说法正确的是( )
如图是茉莉酮酸酯的结构简式,有关该物质的说法正确的是( )| A、该有机物能使酸性高锰酸钾溶液褪色 |
| B、该有机物分子中含有三个亚甲基(-CH2-) |
| C、该有机物可以发生银镜反应 |
| D、该物质在酸性条件下的水解比在碱性条件下的水解程度大 |
对于可逆反应N2+3H2?2NH3,下列说法可以说明反应已达到平衡状态的是( )
| A、N2、H2、NH3的浓度相等 |
| B、N2、H2、NH3的浓度不再发生变化 |
| C、反应停止 |
| D、N2、H2、NH3在容器中共存 |
2.40g A和0.96g B恰好完全反应生成0.04mol C和2.24g D,则C的摩尔质量为( )
| A、17g/mol |
| B、28g/mol |
| C、32g/mol |
| D、44g/mol |
 某温度下的水溶液中,c(H+)=10x mol/L,c(OH-)=10y mol/L.x与y的关系如图所示:
某温度下的水溶液中,c(H+)=10x mol/L,c(OH-)=10y mol/L.x与y的关系如图所示: