题目内容
6.实验室将氯酸钠和亚硫酸钠按物质的量之比1:2倒入烧杯中,水浴加热,同时滴入硫酸溶液,产生棕黄色气体X,反应后测得氯酸钠和亚硫酸钠恰好完全反应,则X为( )| A. | Cl2 | B. | Cl2O | C. | ClO2 | D. | Cl2O7 |
分析 NaClO3中氯元素的化合价由+5价降低,反应中NaClO3为氧化剂,则Na2SO3为还原剂,被氧化为Na2SO4,根据电子转移守恒计算Cl元素在还原产物中的化合价,以此计算.
解答 解:NaClO3中氯元素的化合价由+5价降低,反应中NaClO3为氧化剂,则Na2SO3为还原剂,则Na2SO3被氧化生成+6价S,生成Na2SO4,令Cl元素在还原产物中的化合价为a,则:1×(5-a)=2×(6-4),解得a=1,故该消毒剂的化学式为Cl2O,故选B.
点评 本题考查氧化还原反应的有关计算,难度不大,注意从化合价变化判断氧化剂、还原剂、氧化产物、还原产物等概念,利用电子转移守恒计算.

练习册系列答案
 名师金手指领衔课时系列答案
名师金手指领衔课时系列答案
相关题目
16.下列叙述正确的是( )
| A. | NO的摩尔质量为30g | |
| B. | 常温常压下,14g一氧化碳所占体积为11.2 L | |
| C. | 等物质的量的Na2O2和Na2O中所含阴阳离子总数相等 | |
| D. | 设阿伏加德罗常数为NA,常温常压下O2与O3的混合物32g,含有分子数为NA |
13.下列防止钢铁锈蚀的措施不合理的是 ( )
| A. | 在自行车的钢圈表面镀镍 | B. | 在地下钢铁管道上连接铜块 | ||
| C. | 改变金属内部结构制成不锈钢 | D. | 健身器村刷油漆或包上一层塑料层 |
1.向1LFeBr2溶液中,通入1.12L的Cl2,测得溶液中c(Br-)=3c(Cl-),反应过程中溶液的体积变化不计,则下列说法中正确的是( )
| A. | 原溶液的浓度为0.1mol/L | B. | 反应后溶液中c(Fe3+)=0.1mol/L | ||
| C. | 反应后溶液中c(Fe3+)=c(Fe2+) | D. | 原溶液中c(Br-)=0.4mol/L |
11.下列互为同分异构体的是( )
| A. | O2 和O3 | B. | ${\;}_6^{14}C$和${\;}_6^{12}C$ | ||
| C. | CH4 和CH3CH3 | D. | CH3CH2CH2CH3和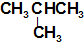 |
18.在化学实验操作中,往往由于读数不规范导致较大的实验误差.下列有关实验中,会导致所配制(或所测定)溶液浓度偏高的是(其他操作均正确)( )
| A. | 配制500 mL 1 mol/L稀硫酸实验中,用量筒量取18 mol/L 浓硫酸时俯视读数 | |
| B. | 配制100 mL 5 mol/L氯化钠溶液实验中,定容时仰视 | |
| C. | 用标准盐酸滴定待测NaOH溶液实验中,使用碱式滴定管开始平视,后来俯视读数 | |
| D. | 用标准NaOH溶液滴定待测盐酸实验中,使用碱式滴定管开始平视,后来俯视读数 |
15.阿伏加德罗常数约为6.02×1023mol-1,下列叙述正确的是( )
| A. | 1mol FeCl3完全水解转化为氢氧化铁胶体后能生成NA个胶粒 | |
| B. | 0.1 L 3 mol•L-1的NH4NO3溶液中含有的NH4+数目为0.3×6.02×1023 | |
| C. | 5.6g铁粉与硝酸反应失去的电子数一定为0.3×6.02×1023 | |
| D. | 4.5gSiO2晶体中含有的硅氧键数目为0.3×6.02×1023 |
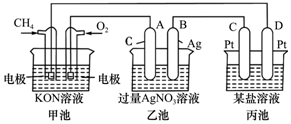 根据下列电化学装置,回答下列问题:
根据下列电化学装置,回答下列问题: 在一定温度下,容器内某一反应中M、N的物质的量随反应时间变化的曲线如图,反应的化学方程式为2N?M.
在一定温度下,容器内某一反应中M、N的物质的量随反应时间变化的曲线如图,反应的化学方程式为2N?M.