题目内容
10.根据下列实验操作和现象所得到的结论正确的是( )| 选项 | 实验操作和现象 | 结论 |
| A | 取少量淀粉水解液于试管中,加入过量氢氧化钠溶液和新制Cu(OH)2悬浊液,加热至沸腾,出现砖红色沉淀. | 淀粉己完全水解 |
| B | 向浓度均为0.1mol•L-1的Na2CO3和Na2S的混合溶液中,滴入少量AgNO3溶液,先产生黑色沉淀(Ag2S). | Ksp(Ag2S)<Ksp(Ag2CO3) |
| C | 向溶液X中先滴加稀硝酸,再滴加BaCl2溶液,出现白色沉淀. | 溶液X中一定含有SO42- |
| D | 溴乙烷与NaOH乙醇溶液共热产生的气体通入KMnO4酸性溶液中,溶液褪色. | 产生的气体为乙烯 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.检验淀粉是否剩余,选择碘水;
B.滴入少量AgNO3溶液,Ksp小的先沉淀;
C.白色沉淀为AgCl或硫酸钡;
D.乙醇及消去反应生成的乙烯均能被高锰酸钾氧化.
解答 解:A.检验淀粉是否剩余,选择碘水,缺少试剂不能说明淀粉是否水解完全,故A错误;
B.滴入少量AgNO3溶液,Ksp小的先沉淀,则先产生黑色沉淀(Ag2S),可知Ksp(Ag2S)<Ksp(Ag2CO3),故B正确;
C.白色沉淀为AgCl或硫酸钡,则原溶液中可能含SO42-、SO32-或银离子,且SO42-、SO32-均不能与银离子同时存在,故C错误;
D.乙醇及消去反应生成的乙烯均能被高锰酸钾氧化,则不能检验乙烯的生成,故D错误;
故选B.
点评 本题考查化学实验方案的评价,为高频考点,把握物质的性质、沉淀转化、离子检验、物质检验、实验技能为解答的关键,侧重分析与实验能力的考查,注意实验的评价性分析,题目难度不大.

练习册系列答案
相关题目
18.短周期主族元素甲、乙、丙、丁、戊的原子序数依次增大,甲和乙形成的气态化合物的水溶液呈碱性,甲和丙同主族,丁原子最外层电子数与电子层数相等,在中学常见的酸中戊的最髙价氧化物对应的水化物的酸性最强.下列叙述错误的是( )
| A. | 氧元素与甲、乙、丙形成的二元化合物均只有两种 | |
| B. | 简单离子半径:戊>乙>丙>丁 | |
| C. | 甲、乙、戊三种元素可形成含有共价键的离子化合物 | |
| D. | 丙、丁、戊三种元素的最高价氧化物对应的水化物两两之间均能发生反应 |
5.在探究Ba2ClO(OH)3•H2O性质的实验中,取该物质溶解后,分别和下列溶液充分混合搅拌,反应后溶液中主要存在的一组离子正确的是( )
| A. | 加入过量浓盐酸:H+、Ba2+、Cl-、ClO- | |
| B. | 加入过量NaHCO3稀溶液:Na+、HCO3-、CO32-、C1O- | |
| C. | 加入过量 Fe(NO3)2溶液:Ba2+、NO3-、Fe2+、C1O- | |
| D. | 加入过量 Na2SO4溶液:Ba+、ClO-、Na+、SO42- |
1.为妥善处理氯甲烷生产企业的副产物CCl4,以减少其对臭氧层的破坏.化学家研究在催化条件下,通过下列反应,使CCl4转化为重要的化工原料氯仿(CHCl3).CCl4+H2?CHCl3+HCl△H=QKJ•mol-1.已知CCl4的沸点为77℃,CHCl3的沸点为61.2℃.在密闭容器中,该反应达到平衡后,测得如下数据(不考虑副反应)
(1)110℃时平衡常数1
(2)实验1中,CCl4的转化率A为60%,平衡时c(CHCl3)=0.48mol/L
(3)实验2中,10小时后达到平衡,H2的平均反应速率为0.05mol/(L•h)
在此实验的平衡体系中,再加入1.0molCCl4和0.5molHCl,平衡将向正反应方向移动(填“向正反应方向”、“向逆反应方向”或“不”);
(4)实验3中,B的值②
①等于50% ②大于50% ③小于50% ④无法判断
(5)能判断该反应已达到化学平衡状态的依据是BC
A.容器中压强不变
B.反应热△H不变
C.v正(H2)=v逆(HCl)
D.混合气体的密度保持不变.
| 实验序号 | 温度℃ | 初始CCl4浓度mol/L | 初始H2浓度mol/L | CCl4的平衡转化率 |
| 1 | 110 | 0.8 | 1.2 | A |
| 2 | 110 | 1 | 1 | 50% |
| 3 | 120 | 1 | 1 | B |
(2)实验1中,CCl4的转化率A为60%,平衡时c(CHCl3)=0.48mol/L
(3)实验2中,10小时后达到平衡,H2的平均反应速率为0.05mol/(L•h)
在此实验的平衡体系中,再加入1.0molCCl4和0.5molHCl,平衡将向正反应方向移动(填“向正反应方向”、“向逆反应方向”或“不”);
(4)实验3中,B的值②
①等于50% ②大于50% ③小于50% ④无法判断
(5)能判断该反应已达到化学平衡状态的依据是BC
A.容器中压强不变
B.反应热△H不变
C.v正(H2)=v逆(HCl)
D.混合气体的密度保持不变.
5.下列说法正确的是( )
| A. | 向某固体上滴加稀盐酸,有气泡产生,则该固体一定是碳酸盐 | |
| B. | 把燃着的木条插入某瓶无色气体中,木条熄灭,证明瓶中的气体是二氧化碳 | |
| C. | 取少量溶液于试管中,滴加氯化钡溶液,有白色沉淀生成,证明该溶液中一定有硫酸根离子 | |
| D. | 不用任何试剂就可以把KOH、HNO3、CuSO4、MgCl2四种溶液鉴别出来 |
6.下列物质放置在空气中,不是因发生氧化还原反应而发生变质的是( )
| A. | Na2SO3 | B. | Na2O2 | C. | NaOH | D. | FeSO4 |
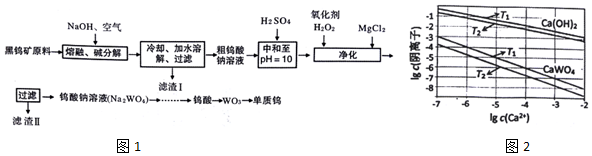
 如图表示A~H八种物质的相互转化关系,其中A为金属单质,其余均为化合物,C为淡黄色粉末,D为常见的无色液体,G能使澄清石灰水变浑浊.
如图表示A~H八种物质的相互转化关系,其中A为金属单质,其余均为化合物,C为淡黄色粉末,D为常见的无色液体,G能使澄清石灰水变浑浊.