题目内容
7.某电镀厂在对金属镀件表面除锈、除污过程中,使用了盐酸、氢氧化钠、碳酸钠.该厂经处理后排放的废水含有H+、OH-、Na+、Fe3+、Cu2+、CO32-、Cl-中的几种离子,某中学生环保志愿者小组对该废水中部分成分进行检测,实验步骤及现象如下表所示.请你填写下表中每步实验现象所对应的实验结论.| 实验步骤及现象 | 实验结论(填离子符号) |
| 取废水样品观察,呈无色 | 废水中不含Cu2+、Fe3+ |
| 测所取废水样品的pH,pH=13 | 废水中含较多的OH- |
| 向废水样品中加入过量的稀盐酸,没有气泡产生 | 废水中不含CO32- |
(1)你推测该废水中除H2O外,还含有的物质是NaOH(写化学式,下同);
(2)不能确定的物质是NaCl.
(3)为了确定可能的物质是否有,应加入的试剂是硝酸、硝酸银.
分析 由取废水样品观察,呈无色,说明废水中不含Cu2+、Fe3+;
由测废水的pH=13,说明废水呈碱性,含有OH-,因H+与OH-反应生成水,所以废水中不含H+,溶液中一定有阳离子,所以废水中一定含有Na+;
由向废水样品中加入过量的稀盐酸,没有气泡产生,说明一定没有CO32-,
不能确定废水中是否含有Cl-,以此来解答.
解答 解:由取废水样品观察,呈无色,说明废水中不含Cu2+、Fe3+;
由测废水的pH=13,说明废水呈碱性,含有OH-,因H+与OH-反应生成水,所以废水中不含H+,溶液中一定有阳离子,所以废水中一定含有Na+;
由向废水样品中加入过量的稀盐酸,没有气泡产生,说明一定没有CO32-,
故答案为:
| 实验步骤及现象 | 实验结论(填离子符号) |
| 取废水样品观察,呈无色 | 废水中不含Cu2+、Fe3+ |
| 测所取废水样品的pH,pH=13 | 废水中含较多的OH- |
| 向废水样品中加入过量的稀盐酸,没有气泡产生 | 废水中不含CO32- |
(1)由上述分析可知,该废水中除H2O外,还含有的物质是NaOH,故答案为:NaOH;
(2)不能确定的物质是NaCl,故答案为:NaCl;
(3)为了确定可能的物质是否有,应加入的试剂是硝酸、硝酸银,先加硝酸无现象,再加硝酸银若生成沉淀则含NaCl,反之不含,故答案为:硝酸、硝酸银.
点评 本题考查离子的推断,为高频考点,把握离子之间的反应、反应与现象的关系解答的关键,侧重分析与推断能力的考查,注意常见离子的检验方法,题目难度不大.

练习册系列答案
相关题目
18.下列离子反应,表达正确的是( )
| A. | 向含有Fe2O3悬浊液中通入HI:Fe2O3+6H+═2Fe3++3H2O | |
| B. | CaCO3与醋酸(CH3COOH)反应:CaCO3+2CH3COOH═Ca2++2CH3COO-+CO2↑+H2O | |
| C. | 向硫酸氢钾溶液中加入Ba(OH)2溶液至pH=7:2H++SO42-+Ba2++2OH-═BaSO4↓+2H2O | |
| D. | MgSO4溶液跟Ba(OH)2溶液反应:SO42-+Ba2+=BaSO4↓ |
15.下列离子在指定的溶液中能大量共存的一组是( )
| A. | 加入甲基橙显红色的溶液中:Mg2+、Fe2+、Cl-、NO3- | |
| B. | pH=12的无色透明溶液中:Mg2+、SO42-、NO3-、K+ | |
| C. | 无色透明溶液中:SO42-、NO3-、Na+、Fe3+ | |
| D. | 澄清透明溶液中:Cu2+、SO42-、K+、Br- |
2.下列装置用于实验室制氨气或验证氨气的某化学性质,其中能达到实验目的是( )
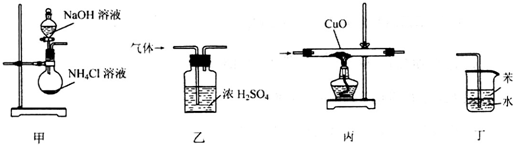

| A. | 用装置甲制取氨气 | B. | 用装置乙除去氨气中的水蒸气 | ||
| C. | 用装置丙验证氨气具有还原性 | D. | 用装置丁吸收尾气 |
17.下列生活中遇到的问题,不涉及到化学变化的是( )
| A. | 用CCl4可擦去圆珠笔油渍 | |
| B. | 蚊虫叮咬处涂抹肥皂水可止痛痒 | |
| C. | 煮鱼时加入少量食醋和料酒可除腥味,增加香味 | |
| D. | 小苏打可用作焙制面包 |
 已知水溶液中CrO42-(黄色)和 Cr2O72-(橙色)间存在如下平衡:2CrO42-+2H+?Cr2O72-+H2O△H<0
已知水溶液中CrO42-(黄色)和 Cr2O72-(橙色)间存在如下平衡:2CrO42-+2H+?Cr2O72-+H2O△H<0 ;
;