题目内容
19.下列说法正确的是( )| A. | 某温度下,Ksp(AgCl)=1.8×10-10,Ksp (Ag2CrO4)=1.9×10-12,故Ag2CrO4更难溶 | |
| B. | 在CaCO3饱和溶液中,加入CaCl2固体,沉淀溶解平衡逆向移动,溶液中Ca2+浓度减小 | |
| C. | 溶度积常数Ksp与温度有关,温度越高,溶度积越大 | |
| D. | 在AgCl饱和溶液中,加入AgCl固体,平衡不移动 |
分析 A.根据Ksp(AgCl)、Ksp(Ag2CrO4)计算生成AgCl、Ag2CrO4沉淀时银离子的浓度,比较大小后确定谁先沉淀;
B.加入CaCl2固体,Ca2+浓度增大;
C.如升高温度,溶解度降低,则溶度积减小;
D.为饱和溶液,加入固体,浓度不变.
解答 解:A.AgCl饱和所需Ag+浓度c(Ag+)=$\frac{Ksp(AgCl)}{C(C{l}^{-})}$=$\frac{1.8×1{0}^{-10}}{0.01}$=1.8×10-8mol/L,Ag2CrO4饱和所需Ag+浓度c(Ag+)=$\sqrt{\frac{Ksp}{c(Cr{{O}_{4}}^{2-})}}$=$\sqrt{\frac{1.9×1{0}^{-12}}{0.001}}$mol/L=4.36×10-5mol/L,则1.8×10-8mol/L<4.36×10-5mol/L,所以Cl-先沉淀,则AgCl更难溶,故A错误;
B.加入CaCl2固体,虽然平衡逆向移动,但Ca2+浓度增大,故B错误;
C.如升高温度,溶解度降低,则溶度积减小,故C错误;
D.为饱和溶液,加入固体,浓度不变,平衡不移动,故D正确.
故选D.
点评 本题考查了难溶电解质的溶解平衡及沉淀转化的本质,为高频考点,侧重于学生的分析、计算能力的考查,易错点为A,注意根据Ksp计算,题目难度中等.

练习册系列答案
 新课标同步训练系列答案
新课标同步训练系列答案 一线名师口算应用题天天练一本全系列答案
一线名师口算应用题天天练一本全系列答案
相关题目
4.下列关于胶体的认识错误的是( )
| A. | 河流三角洲的形成与胶体的性质无关 | |
| B. | 清晨在密林中看到的一缕缕光束,是丁达尔现象的表现 | |
| C. | 向沸水中逐滴加入FeCl3溶液并加热至液体呈透明的红褐色,可得氢氧化铁胶体 | |
| D. | 胶体粒子的直径大小在1~100nm之间 |
5.汽车剧烈碰撞时,安全气囊中发生反应10NaN3+2KNO3═K2O+5Na2O+16N2↑.对于该反应,下列判断正确的是( )
| A. | 氧化产物与还原产物分子个数之比为15:1 | |
| B. | 氧化剂和还原剂是同一物质 | |
| C. | 反应过程中转移1mol电子,则产生2.24L气体(标准状况) | |
| D. | NaN3中氮元素的化合价为-3 |
7.已知lg2=0.3,KSP[Cr(OH)3]=6.4×10-31.某工厂进行污水处理时,要使污水中的Cr3+以Cr(OH)3形式除去,当c(Cr3+)=1×10-5时,可以认为Cr3+沉淀完全,溶液的pH至少为( )
| A. | 4.4 | B. | 5.6 | C. | 6.7 | D. | 8.4 |
14.已知25℃时,电离常数Ka(HX)=3.6×10-4,溶度积常数Ksp(CaX2)=1.46×10-10.现向1L 0.2mol/LHX溶液中加入1L 0.2mol/LCaCl2溶液,则下列说法中正确的是( )
| A. | 25℃时,0.1 mol/LHX溶液中pH=1 | |
| B. | Ksp(CaX2)随温度和浓度的变化而变化 | |
| C. | 该体系中,c(Cl-)=c(Ca2+) | |
| D. | 该体系中HX与CaCl2反应产生沉淀 |
9.醇与氢卤酸反应是制备卤代烃的重要方法.实验室制备溴乙烷和1-溴丁烷的反应如下:
NaBr+H2SO4═HBr+NaHSO4 ①
R-OH+HBr?R-Br+H2O ②
可能存在的副反应有:醇在浓硫酸的存在下脱水生成烯和醚,Br-被浓硫酸氧化为Br2等.有关数据列表如下;
请回答下列问题:
(1)溴乙烷和1-溴丁烷的制备实验中,下列仪器最不可能用到的是d.(填字母)
a.圆底烧瓶 b.量筒 c.锥形瓶 d.蒸发皿
(2)溴代烃的水溶性大于(填“大于”、“等于”或“小于”)醇.
(3)将1-溴丁烷粗产品置于分液漏斗中加水,振荡后静置,产物在下层(填“上层”、“下层”或“不分层”).
(4)制备操作中,加入的浓硫酸必需进行稀释,其目的是abc.(填字母)
a.减少副产物烯和醚的生成 b.减少Br2的生成
c.减少HBr的挥发 d.水是反应的催化剂
(5)欲除去溴代烷中的少量杂质Br2,下列物质中最适合的是c.(填字母)
a.NaI b.NaOH c.NaHSO3 d.KCl
(6)在制备溴乙烷时,采用边反应边蒸出产物的方法,其有利于平衡向生成溴乙烷的方向移动;但在制备1-溴丁烷时却不能边反应边蒸出产物,其原因是1-溴丁烷和正丁醇的沸点相差不大.
NaBr+H2SO4═HBr+NaHSO4 ①
R-OH+HBr?R-Br+H2O ②
可能存在的副反应有:醇在浓硫酸的存在下脱水生成烯和醚,Br-被浓硫酸氧化为Br2等.有关数据列表如下;
| 乙醇 | 溴乙烷 | 正丁醇 | 1-溴丁烷 | |
| 密度/g•cm-3 | 0.7893 | 1.4604 | 0.8098 | 1.2758 |
| 沸点/℃ | 78.5 | 38.4 | 117.2 | 101.6 |
(1)溴乙烷和1-溴丁烷的制备实验中,下列仪器最不可能用到的是d.(填字母)
a.圆底烧瓶 b.量筒 c.锥形瓶 d.蒸发皿
(2)溴代烃的水溶性大于(填“大于”、“等于”或“小于”)醇.
(3)将1-溴丁烷粗产品置于分液漏斗中加水,振荡后静置,产物在下层(填“上层”、“下层”或“不分层”).
(4)制备操作中,加入的浓硫酸必需进行稀释,其目的是abc.(填字母)
a.减少副产物烯和醚的生成 b.减少Br2的生成
c.减少HBr的挥发 d.水是反应的催化剂
(5)欲除去溴代烷中的少量杂质Br2,下列物质中最适合的是c.(填字母)
a.NaI b.NaOH c.NaHSO3 d.KCl
(6)在制备溴乙烷时,采用边反应边蒸出产物的方法,其有利于平衡向生成溴乙烷的方向移动;但在制备1-溴丁烷时却不能边反应边蒸出产物,其原因是1-溴丁烷和正丁醇的沸点相差不大.
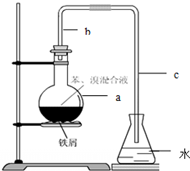
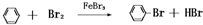 .
.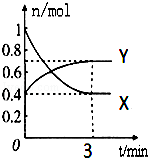 在一定温度下,体积为2L的密闭容器中,NO2和N2O4之间发生反应:2NO2(g)(红棕色)?N2O4g)(无色),如图所示.
在一定温度下,体积为2L的密闭容器中,NO2和N2O4之间发生反应:2NO2(g)(红棕色)?N2O4g)(无色),如图所示.