题目内容
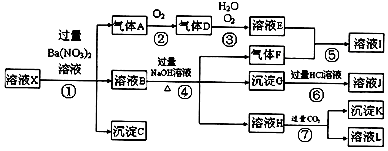
3.下列从海洋中获取物质的方案不合理的是( )| A. | 粗盐先通过除杂、精制得到饱和食盐水,然后电解得到氯气,最后和石灰乳反应制得漂白粉 | |
| B. | 苦卤酸化后通入氯气得到溴水,然后用热空气将其通入到SO2水溶液中,最后通入氯气后蒸馏得粗溴 | |
| C. | 干海带灼烧后加水浸取,然后加入H2O2得到碘水,最后通过萃取、分液、蒸馏得到碘单质 | |
| D. | 向海水中加入石灰乳得到Mg(OH)2,加入盐酸得到MgCl2溶液,最后电解该溶液得到镁单质 |
分析 A.粗盐提纯得到氯化钠溶液,电解饱和氯化钠反应生成氯气,氯气和石灰乳反应生成氯化钙、次氯酸钙和水;
B.苦卤中含浓度较大的 溴离子,通入氧化剂氯气氧化溴离子生成溴单质,热空气吹出后用二氧化硫吸收富集溴,再通入氯气氧化得到溴单质;
C.海带提取碘的方法是灼烧后水浸,溶液中加入过氧化氢氧化碘离子得到碘单质,加入萃取剂萃取分液得到含碘单质的有机层,蒸馏得到碘单质;
D.电解氯化镁溶液得到氢氧化镁、氯气和氢气;
解答 解:A.粗盐先通过除杂除去镁离子、硫酸根离子、钙离子等,精制得到饱和食盐水,然后电解饱和食盐水得到氯气,最后氯气和石灰乳反应制得漂白粉,获取物质的方案合理,故A正确;
B.苦卤酸化后通入氯气得到溴水,热空气吹出后用二氧化硫吸收富集溴,再通入氯气氧化得到溴单质,方案合理,故B正确;
C.干海带灼烧后加水浸取,然后加入H2O2得到碘水,最后通过萃取、分液、蒸馏得到碘单质,方案合理,故C正确;
D.向海水中加入石灰乳得到Mg(OH)2,加入盐酸得到MgCl2溶液,蒸发浓缩,结晶析出氯化镁晶体,氯化氢气流中失去水得到氯化镁固体,最后电解人氯化镁得到镁单质,方案不合理,故D错误;
故选D.
点评 本题考查了海水资源的利用、海水提纯氯化钠、海水提溴、海水提取碘、海水提取镁等生产流程,掌握基础是解题关键,题目难度中等.

练习册系列答案
相关题目
3.下列同学的饮食习惯科学的是( )
| A. | 多吃肉,少吃蔬菜水果 | |
| B. | 合理摄入糖类.油脂等,注意膳食平衡 | |
| C. | 为防止变胖,炒菜时不放油 | |
| D. | 适量饮用矿泉水对身体健康有益 |
14.已知温度T时,水的离子积常数为Kw,该温度下,将浓度为a mol•L-1的一元酸HA溶液与b mol•L-1的一元碱BOH溶液等体积混合,可判断该溶液一定呈中性的依据是( )
| A. | 混合溶液的PH=7 | B. | 混合溶液中,C(H+)=$\sqrt{Kw}$mol•L-1 | ||
| C. | a=b | D. | 混合溶液中,C(H+)+C(B+)=C(OH-)+C(A-) |
11.下列各组离子无色,且能够大量共存于同一溶液中的是( )
| A. | OH-、NO3-、K+、Na+ | B. | H+、Fe3+、SO42-、Cl- | ||
| C. | K+、Cu2+、Cl-、CO32- | D. | Al3+、Fe2+、NO3-、OH- |
18.下列说法中正确的是( )
| A. | 生理盐水指质量分数为0.9%的NaCl溶液 | |
| B. | 1L 0.2mol/L硫酸铁溶液中含有的SO42-的离子数为0.2NA | |
| C. | 1L 1 mol/L K2CO3溶液中含有的钾离子数目为NA | |
| D. | 0.1 mol/L BaCl2溶液中,Cl-的物质的量浓度为0.1 mol/L |
8.现有甲、乙两瓶无色溶液,已知它们可能为AlCl3溶液和NaOH溶液.现做如下实验,请回答:
(1)甲瓶溶液为AlCl3溶液.
(2)乙瓶溶液为NaOH溶液,其物质的量浓度为0.5mol•L-1.
| 实验① | 实验② | 实验③ | |
| 取甲瓶溶液的量 | 400mL | 120mL | 120mL |
| 取乙瓶溶液的量 | 120mL | 440mL | 400mL |
| 生成沉淀的量 | 1.56g | 1.56g | 3.12g |
(2)乙瓶溶液为NaOH溶液,其物质的量浓度为0.5mol•L-1.
12.具有手性碳原子的物质往往具有旋光性,存在对映异构体,下列化合物中存在对映异构体的是( )
| A. | CH3CHClCH2CH3 | B. | CH3CHBrCH3 | C. | 新戊烷 | D. | CH3COOH |