题目内容
X、Y、Z、L、M五种元素的原子序数依次增大.X、Y、Z、L是组成蛋白质的基础元素,M是地壳中含量最高的金属元素.
回答下列问题:
(1)L的元素符号为 ;M在元素周期表中的位置为 ;五种元素的原子半径从大到小的顺序是 (用元素符号表示).
(2)Z、X两元素按原子数目比l:3和2:4构成分子A和B,A的电子式为 ,B的结构式为 .在标况下,将A 充满一个干燥烧瓶,将烧瓶倒置于水中,瓶内液面上升,(假设溶质不扩散)最后烧瓶内溶液的物质的量浓度为 (精确到0.001)
(3)硒(Se)是人体必需的微量元素,与L同一主族,Se原子比L原子多两个电子层,则Se的原子序数为 ,其最高价氧化物对应的水化物化学式为 .
(4)同温同压下,70mLZL2与10mlL2混合与水反应后,余下的气体为 ,体积为 mL.(填化学式)
回答下列问题:
(1)L的元素符号为
(2)Z、X两元素按原子数目比l:3和2:4构成分子A和B,A的电子式为
(3)硒(Se)是人体必需的微量元素,与L同一主族,Se原子比L原子多两个电子层,则Se的原子序数为
(4)同温同压下,70mLZL2与10mlL2混合与水反应后,余下的气体为
考点:位置结构性质的相互关系应用
专题:
分析:M是地壳中含量最高的金属元素,所以M是Al,X、Y、Z、L是组成蛋白质的基础元素,且X、Y、Z、L、M五种元素的原子序数依次增大,所以X、Y、Z、L分别是H、C、N、O,据此进行解答.
解答:
解:M是地壳中含量最高的金属元素,所以M是Al,X、Y、Z、L是组成蛋白质的基础元素,且X、Y、Z、L、M五种元素的原子序数依次增大,所以X、Y、Z、L分别是H、C、N、O,
(1)L的元素符号为O,Al位于周期表中第3周期,第ⅢA族,电子层越多半径越大,所以金属铝的半径最大,H的半径最小,同周期元素的原子从左到右半径逐渐减小,所以C>N>O,故原子半径大小顺序为:Al>C>N>O>H,
故答案为:O;第3周期第ⅢA族; Al>C>N>O>H;
(2)N和H两元素按原子数目比l:3和2:4构成分子NH3和N2H4,均属由共价键构成的共价化合物,氨气的电子式为: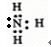 ,N2H4的结构式为:
,N2H4的结构式为: ;设烧瓶容积为1L,则氨气的物质的量为:
;设烧瓶容积为1L,则氨气的物质的量为:
≈0.045mol,该溶液的浓度为:
=0.045mol/L,
故答案为: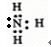 ;
; ;0.045mol/L;
;0.045mol/L;
(3)Se与O同一主族,Se原子比O原子多两个电子层,即电荷数多26,其原子结构示意图为 ,则Se的原子序数为34,其最高价氧化物对应的水化物化学式为H2SeO4,
,则Se的原子序数为34,其最高价氧化物对应的水化物化学式为H2SeO4,
故答案为:34;H2SeO4;
(4)Z、L分别为N、O,ZL2为NO2,L2为O2,二氧化氮、氧气与水反应生成硝酸、二氧化氮与水反应生成NO,反应的化学方程式为:4NO2+2H2O+O2═4HNO3、3NO2+H2O═2HNO3+NO;10mL氧气完全反应消耗40mL二氧化氮,还剩余的(70mL-40mL)=30mL二氧化氮与水反应生成NO,所以最后剩余的气体为NO,其体积为:30mL×
=10mL,
故答案为:NO;10mL.
(1)L的元素符号为O,Al位于周期表中第3周期,第ⅢA族,电子层越多半径越大,所以金属铝的半径最大,H的半径最小,同周期元素的原子从左到右半径逐渐减小,所以C>N>O,故原子半径大小顺序为:Al>C>N>O>H,
故答案为:O;第3周期第ⅢA族; Al>C>N>O>H;
(2)N和H两元素按原子数目比l:3和2:4构成分子NH3和N2H4,均属由共价键构成的共价化合物,氨气的电子式为:
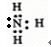 ,N2H4的结构式为:
,N2H4的结构式为: ;设烧瓶容积为1L,则氨气的物质的量为:
;设烧瓶容积为1L,则氨气的物质的量为:| 1L |
| 22.4L/mol |
| 0.045mol |
| 1L |
故答案为:
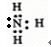 ;
; ;0.045mol/L;
;0.045mol/L;(3)Se与O同一主族,Se原子比O原子多两个电子层,即电荷数多26,其原子结构示意图为
 ,则Se的原子序数为34,其最高价氧化物对应的水化物化学式为H2SeO4,
,则Se的原子序数为34,其最高价氧化物对应的水化物化学式为H2SeO4,故答案为:34;H2SeO4;
(4)Z、L分别为N、O,ZL2为NO2,L2为O2,二氧化氮、氧气与水反应生成硝酸、二氧化氮与水反应生成NO,反应的化学方程式为:4NO2+2H2O+O2═4HNO3、3NO2+H2O═2HNO3+NO;10mL氧气完全反应消耗40mL二氧化氮,还剩余的(70mL-40mL)=30mL二氧化氮与水反应生成NO,所以最后剩余的气体为NO,其体积为:30mL×
| 1 |
| 3 |
故答案为:NO;10mL.
点评:本题考查了位置、结构与性质关系的综合应用,题目难度中等,正确推断各元素名称为解答关键,注意掌握常见化学用语的表示方法,明确原子结构与元素周期律、元素周期表的关系.

练习册系列答案
 智能训练练测考系列答案
智能训练练测考系列答案
相关题目
下列实验方案不可行或结论不正确的是( )
| A、向Mg(OH)2悬浊液中滴加FeCl3溶液,出现红褐色沉淀,说明溶解度:Fe(OH)3<Mg(OH)2 |
B、 通过观察如图中导管水柱的变化,验证铁钉生锈的原因主要是吸氧腐蚀 |
| C、用润湿的pH试纸测定饱和Na2CO3溶液pH |
| D、向同pH、同体积的醋酸和盐酸溶液中加入足量镁粉,通过完全反应后收集到的H2体积,比较两种酸的电离程度:醋酸<盐酸 |
在含有浓度均为0.01mol?L-1的Cl-、Br-、I-离子的溶液中,缓慢且少量的加入AgNO3稀溶液,结合溶解度判断析出三种沉淀的先后顺序是( )
| A、AgCl、AgBr、AgI |
| B、AgI、AgBr、AgCl |
| C、AgBr、AgCl、AgI |
| D、三种沉淀同时析出 |
常温下,有体积相同的四种溶液:①pH=3的CH3COOH溶液;②pH=3的盐酸;③pH=11的氨水;④pH=11的NaOH溶液.下列说法正确的是( )
| A、①和②混合溶液中:c(H+)=3.0mol?L-1 |
| B、①和④混合溶液中:c(Na+)=c(CH3COO-)+c(CH3COOH) |
| C、②和③混合溶液中:c(Cl-)+c(H+)>c(NH4+)+c(OH-) |
| D、四种溶液稀释100倍,溶液的pH:③>④>②>① |
“封管实验”具有简易、方便、节约、绿色等优点,观察下面四个“封管实验”(夹持装置未画出),判断下列说法正确的是( )


| A、加热时,①上部汇集了固体NH4C1,说明NH4C1沸点很低,易升华 |
| B、四个“封管实验”中都发生了化学反应 |
| C、加热时,②、③溶液均变红,冷却后又都变为无色 |
| D、④中,左右相同的容器中分别充入相同的二氧化氮,浸泡在热水中的容器内二氧化氮的浓度小 |
化学知识与日常生活密切相关.下列说法不正确的是( )
| A、镀锡铁板比镀锌铁板更耐腐蚀 |
| B、水常温下呈液态,冰浮在水面上,均与氢键有关 |
| C、用纯碱溶液清洗油污时,加热可增强其去污能力 |
| D、锅炉水垢中含有的CaSO4,可先用Na2CO3溶液处理,后用酸除去 |
下列实验,能成功的是( )
| A、苯和溴水、铁屑混合制溴苯 |
| B、用溴水除乙烷中混有的乙烯 |
| C、苯与浓硝酸和浓硫酸的混合物共热至70℃~80℃制硝基苯 |
| D、用酒精和浓盐酸通过加热来制取乙烯 |
