题目内容
常温下,浓度均为0.1mol/L的三种溶液:①CH3COOH溶液②NaOH溶液③CH3COONa溶液.下列说法中不正确的是(忽略混合前后溶液体积变化)( )
| A、溶液的pH值:②>③>① |
| B、水电离出的c(OH-):③>①>② |
| C、①和②等体积混合后的溶液:c(CH3COOH)+c(CH3COO-)=0.05mol/L |
| D、室温,碳酸钙在①中的ksp比在水中的大 |
考点:弱电解质在水溶液中的电离平衡,盐类水解的应用
专题:电离平衡与溶液的pH专题,盐类的水解专题
分析:A.碱溶液的pH>水解显碱性的盐溶液的pH>酸溶液的pH;
B.酸碱抑制水的电离,能水解的盐促进水的电离;
C.①和②等体积混合后恰好反应生成醋酸钠,其浓度为0.05mol/L;
D.ksp只受温度影响.
B.酸碱抑制水的电离,能水解的盐促进水的电离;
C.①和②等体积混合后恰好反应生成醋酸钠,其浓度为0.05mol/L;
D.ksp只受温度影响.
解答:
解:A.碱溶液的pH>水解显碱性的盐溶液的pH>酸溶液的pH,则相同浓度时溶液的pH值为②>③>①,故A正确;
B.酸碱抑制水的电离,且②中氢氧根离子浓度大,能水解的盐促进水的电离,则水电离出的c(OH-)为③>①>②,故B正确;
C.①和②等体积混合后恰好反应生成醋酸钠,其浓度为0.05mol/L,由物料守恒可知,c(CH3COOH)+c(CH3COO-)=0.05mol/L,故C正确;
D.ksp只受温度影响,温度不变其数值不变,故D错误;
故选D.
B.酸碱抑制水的电离,且②中氢氧根离子浓度大,能水解的盐促进水的电离,则水电离出的c(OH-)为③>①>②,故B正确;
C.①和②等体积混合后恰好反应生成醋酸钠,其浓度为0.05mol/L,由物料守恒可知,c(CH3COOH)+c(CH3COO-)=0.05mol/L,故C正确;
D.ksp只受温度影响,温度不变其数值不变,故D错误;
故选D.
点评:本题考查离子浓度大小的比较,熟悉溶液中的电荷守恒、物料守恒、盐的水解及电离等知识即可解答,题目难度中等,选项B为易错点.

练习册系列答案
相关题目
下列各式中属于正确的水解反应离子方程式的是( )
| A、NH4++H2O?NH3?H2O+H+ |
| B、S2-+2H2O?H2S+2OH- |
| C、CH3COOH+H2O?CH3COO-+H3O+ |
| D、HS-+H3O+?H2S+H2O |
下列溶液一定呈中性的是( )
| A、pH=7的溶液 |
| B、c(H+)=c(OH-)=10-6mol/L溶液 |
| C、酸与碱恰好完全反应生成正盐的溶液 |
| D、加入酚酞试剂呈无色的溶液 |
在一定条件下,对于A2(g)+3B2(g)?2AB3(g)反应来说,下列所表示的化学反应速率中最大的是( )
| A、v(A2)=0.8mol?L-1?s-1 |
| B、v(A2)=40mol?L-1?min-1 |
| C、v(AB3)=1.0mol?L-1?s-1 |
| D、v(B2)=1.2mol?L-1?s-1 |
下列图示与对应的叙述相符的是( )


| A、图1表示某吸热反应分别在有、无催化剂的情况下反应过程中的能量变化 |
| B、图2表示0.1000 mol?L-1NaOH溶液滴定20.00mL0.1000 mol?L-1CH3COOH溶液所得到的滴定曲线 |
| C、图3表示KNO3的溶解度曲线,图中a点所示的溶液是80℃时KNO3的不饱和溶液 |
| D、图4表示某可逆反应生成物的量随反应时间变化的曲线,由图知t时v逆>v正 |
 如图中A为淡黄色的固体,B、C为溶液,D为气体,E、F为白色沉淀.
如图中A为淡黄色的固体,B、C为溶液,D为气体,E、F为白色沉淀.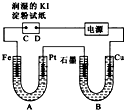 电解装置如图所示.图中B装置盛1L3mol?L-1K2SO4溶液,A装置中盛1L3mol?L-1AgNO3溶液.通电一段时间后,润湿的淀粉KI试纸的C端变蓝色.试回答:
电解装置如图所示.图中B装置盛1L3mol?L-1K2SO4溶液,A装置中盛1L3mol?L-1AgNO3溶液.通电一段时间后,润湿的淀粉KI试纸的C端变蓝色.试回答: (1)如图为牺牲阳极的阴极保护法的实验装置,此装置中Zn电极上的电极反应为
(1)如图为牺牲阳极的阴极保护法的实验装置,此装置中Zn电极上的电极反应为 一定质量的理想气体,经过如图所示的由A经B到C的状态变化.设状态A的温度为400K.求:
一定质量的理想气体,经过如图所示的由A经B到C的状态变化.设状态A的温度为400K.求: