题目内容
常温下,将V1mL c1 mol/L的醋酸溶液滴加到V2 mL c2 mol/L的氢氧化钠溶液中,下列结论正确的是( )
| A、若V1=V2,且溶液的pH>7,则一定有c1<c2 |
| B、若混合液的pH=7,则一定有c1v1>c2v2 |
| C、若混合液的pH=7,则混合液中c(CH3COO-)>c(Na+) |
| D、若c1V1=c2V2,则混合溶液中有c(OH-)>c(CH3COOH)+c(H+) |
考点:酸碱混合时的定性判断及有关ph的计算
专题:电离平衡与溶液的pH专题
分析:A.醋酸是弱电解质,在其水溶液里存在电离平衡,当醋酸与氢氧化钠的物质的量相等时恰好生成醋酸钠,醋酸根离子水解,溶液显示碱性,而此时V1=V2、c1=c2;
B.当c1V1=c2V2时,反应生成醋酸钠,溶液显示碱性,如果混合液的pH=7,则醋酸应该稍过量;
C.混合液的pH=7,c(OH-)=c(H+),根据电荷守恒可知c(CH3COO-)=c(Na+);
D.此时溶液中的溶质为醋酸钠,根据醋酸钠溶液中的质子守恒判断.
B.当c1V1=c2V2时,反应生成醋酸钠,溶液显示碱性,如果混合液的pH=7,则醋酸应该稍过量;
C.混合液的pH=7,c(OH-)=c(H+),根据电荷守恒可知c(CH3COO-)=c(Na+);
D.此时溶液中的溶质为醋酸钠,根据醋酸钠溶液中的质子守恒判断.
解答:
解:A.V1=V2、c1=c2时,醋酸与氢氧化钠的物质的量相等,二者反应生成醋酸钠,由于醋酸根离子的水解,溶液显示碱性,溶液的pH>7,所以,若V1=V2,且溶液的pH>7,不一定满足c1<c2,故A错误;
B.当c1V1=c2V2时,反应后的溶质为醋酸钠,醋酸根离子的水解,溶液显示碱性,若混合液的pH=7,则醋酸应该稍过量,c1v1>c2v2,故B正确;
C.若混合溶液的pH=7,则c(OH-)=c(H+),根据电荷守恒c(CH3COO-)+c(OH-)=c(H+)+c(Na+)可知:c(CH3COO-)=c(Na+),故C错误;
D.若c1V1=c2V2,氢氧化钠与醋酸的物质的量相等,二者反应生成醋酸钠,根据醋酸钠溶液中的质子守恒可得:c(OH-)=c(CH3COOH)+c(H+),故D错误;
故选B.
B.当c1V1=c2V2时,反应后的溶质为醋酸钠,醋酸根离子的水解,溶液显示碱性,若混合液的pH=7,则醋酸应该稍过量,c1v1>c2v2,故B正确;
C.若混合溶液的pH=7,则c(OH-)=c(H+),根据电荷守恒c(CH3COO-)+c(OH-)=c(H+)+c(Na+)可知:c(CH3COO-)=c(Na+),故C错误;
D.若c1V1=c2V2,氢氧化钠与醋酸的物质的量相等,二者反应生成醋酸钠,根据醋酸钠溶液中的质子守恒可得:c(OH-)=c(CH3COOH)+c(H+),故D错误;
故选B.
点评:本题考查了酸碱混合的定性判断、溶液中离子浓度定性比较,题目难度中等,注意掌握酸碱混合后的定性判断方法,明确弱电解质在溶液中存在电离平衡,能够根据电荷守恒、质子守恒等知识判断溶液中各离子浓度大小.

练习册系列答案
相关题目
化学与生产、生活、社会密切相关.下列有关说法中,不正确的是( )
| A、PM2.5的颗粒物,分散在空气中可形成胶体 |
| B、汽车尾气不仅能形成光化学污染还能破坏臭氧层 |
| C、对废旧电池进行回收处理主要为了防止重金属污染水源 |
| D、富含氮、磷的生活污水不能排放到河中,但可以直接用于农田的灌溉 |
下列叙述不正确的是( )
| A、闪电时,空气中的氮气直接转化为二氧化氮 |
| B、实验室可用浓硫酸干燥二氧化硫 |
| C、不能用稀硝酸和活泼金属反应制氢气 |
| D、将足量二氧化硫通入酸性高锰酸钾试液中,溶液褪色说明二氧化硫具有还原性 |
0.1mol/L的Na2S溶液中,有关粒子的浓度大小关系正确的是( )
| A、c(Na+)+c(H+)=c(S2-)+c(HS-)+c(OH-) |
| B、c(Na+)+c(H+)=2c(S2-)+c(HS-)+c(OH-) |
| C、c(Na+)=c(S2-)+c(HS-)+c(H2S) |
| D、c(Na+)=2c(S2-)+2c(HS-)+c(H2S) |
下列各式中属于正确的水解反应离子方程式的是( )
| A、NH4++H2O?NH3?H2O+H+ |
| B、S2-+2H2O?H2S+2OH- |
| C、CH3COOH+H2O?CH3COO-+H3O+ |
| D、HS-+H3O+?H2S+H2O |
 如图中A为淡黄色的固体,B、C为溶液,D为气体,E、F为白色沉淀.
如图中A为淡黄色的固体,B、C为溶液,D为气体,E、F为白色沉淀.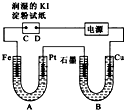 电解装置如图所示.图中B装置盛1L3mol?L-1K2SO4溶液,A装置中盛1L3mol?L-1AgNO3溶液.通电一段时间后,润湿的淀粉KI试纸的C端变蓝色.试回答:
电解装置如图所示.图中B装置盛1L3mol?L-1K2SO4溶液,A装置中盛1L3mol?L-1AgNO3溶液.通电一段时间后,润湿的淀粉KI试纸的C端变蓝色.试回答: 一定质量的理想气体,经过如图所示的由A经B到C的状态变化.设状态A的温度为400K.求:
一定质量的理想气体,经过如图所示的由A经B到C的状态变化.设状态A的温度为400K.求: