题目内容
5. X、Y、Z、W、R五种元素位于元素周期表前四周期,它们的原子序数依次增大
X、Y、Z、W、R五种元素位于元素周期表前四周期,它们的原子序数依次增大| 元素 | 相关信息 |
| X | 原子核外的价电子排布式为nsnnp2n |
| Y | 元素周期表中电负性最强的元素 |
| Z | Z与W位于同周期,且最外层有两个未成对电子 |
| w | 单质为淡黄色固体,能在火山口发现 |
| R | 原子的基态未成对电子致是同周期最多的元素 |
(l)R元素在元素周期表中的位置是第四周期第ⅥB族,该原子核外电子排布式是1s22s22p63s23p63d54s1
(2)元素X和Z形成化合物的晶体类型为原子晶体,高温下,该化合物与碳单质反应制备2单质的化学方
程式为SiO2+2C$\frac{\underline{\;高温\;}}{\;}$Si+2CO↑
(3)X与Y形成的化合物XY2的空间构型是V形,元素X与W形成的WX42中W原子的杂化轨道类
型是SP3杂化
(4)X与碳、氢元素形成的CH2X2分子中含有4个键和1个键
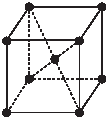
(5)金属R晶体是一种体心立方结构(如图所示),实验测得金属R的密度为dg•cm3摩尔质量为Mg•mol-1,NA为阿伏加德罗常数的数值,每个晶胞中含有2个R原子,晶胞的边长为$\root{3}{\frac{2M}{{N}_{A}d}}$ cm.
分析 X、Y、Z、W、R是元素周期表前四周期元素中的五种常见元素,其原子序数依次增大.X的基态原子的最外层电子排布式为nsnnp2n,s能级容纳2个电子,则n=2,故X为O元素;Y是元素周期表中电负性最强的元素,Y为F,W单质为淡黄色固体,能在火山口发现,W为S,Z与W位于同周期,且最外层有两个未成对电子,Z为Si,R原子的基态未成对电子致是同周期最多的元素,核外电子排布式为1s22s22p63s23p63d54s1,故W为Cr,据此解答.
解答 解:X、Y、Z、W、R是元素周期表前四周期元素中的五种常见元素,其原子序数依次增大.X的基态原子的最外层电子排布式为nsnnp2n,s能级容纳2个电子,则n=2,故X为O元素;Y是元素周期表中电负性最强的元素,Y为F,W单质为淡黄色固体,能在火山口发现,W为S,Z与W位于同周期,且最外层有两个未成对电子,Z为Si,R原子的基态未成对电子致是同周期最多的元素,核外电子排布式为1s22s22p63s23p63d54s1,故W为Cr,
(1)R为Cr元素,位于元素周期表第四周期第ⅥB族,其基态原子的核外电子排布式为1s22s22p63s23p63d54s1,
故答案为:第四周期第ⅥB族;1s22s22p63s23p63d54s1;
(2)X为O,Z为Si,形成的物质二氧化硅为原子晶体,高温下,该化合物与碳单质反应的方程式为SiO2+2C$\frac{\underline{\;高温\;}}{\;}$Si+2CO↑,
故答案为:原子晶体;SiO2+2C$\frac{\underline{\;高温\;}}{\;}$Si+2CO↑;
(3)X与Y形成的化合物XY2为OF2,价层电子对数为$2+\frac{1}{2}(6-2×1)$=4,空间构型为V形,SO42-中心原子的价层电子对数为4,杂化类型为SP3杂化,
故答案为:V形;SP3杂化;
(4)CH2O2分子为甲酸,单键均为键,有4个西格玛键,双键中有一个西格玛键,1个π键,分子中只有一个碳氧双键,个有1个π键,
故答案为:4;1;
(5)[Fe(CN)6]3-离子中阳离子与CN-之间的共价键称为配位键,该化学键能够形成的原因是:Fe3+离子有空轨道,CN-离子有孤对电子,
故答案为:配位键;Fe3+离子有空轨道,CN-离子有孤对电子;
(6)R晶体的每个晶胞中含有R原子数目为8×$\frac{1}{8}$+1=2,根据密度ρ=$\frac{\frac{nM}{{N}_{A}}}{{a}^{3}}$,d=$\frac{2M}{{a}^{3}{N}_{A}}$,边长a=$\root{3}{\frac{2M}{{N}_{A}d}}$cm,
故答案为:2;$\root{3}{\frac{2M}{{N}_{A}d}}$.
点评 本题是对物质结构与性质的考查,涉及核外电子排布、元素周期律、杂化方式与空间构型判断、晶胞计算等,是对学生基础知识的综合应用.

| A. | 青铜、不锈钢、硬铝都是合金 | |
| B. | 铜表面易形成致密的氧化膜 | |
| C. | 铜与O2反应,生成黑色的Cu2O | |
| D. | CuSO4•5H2O是一种混合物,加热后变为白色粉末 |
| A. | 2mol SO2和1mol O2在一定条件下充分反应后,所得混合气体的分子数小于2NA | |
| B. | 由1mol CH3COONa和少量CH3COOH形成的中性溶液中,CH3COO-数目为NA个 | |
| C. | 常温常压下,14g由N2与CO组成的混合气体含有的原子数目为NA | |
| D. | 标准状况下,6.72L NO2与水充分反应转移的电子数目为0.2NA |
| A. | 从开始到平衡A的平均反应速率为0.3mol/(Ls) | |
| B. | 从开始到平衡B的转化率为60% | |
| C. | 此反应的化学平衡常数表达式K=$\frac{c(C)•{c}^{2}(D)}{{c}^{3}(A)•c(B)}$ | |
| D. | 若混合气体的密度不再改变时,该反应一定达到平衡状态 |
| A. | 按系统命名法,有机物 的命名为2,2,4,4,5-五甲基-3,3-二乙基己烷 的命名为2,2,4,4,5-五甲基-3,3-二乙基己烷 | |
| B. | 人造纤维,合成纤维都是有机高分子化合物 | |
| C. | 某有机物含有C、H、O、N四种元素,其球棍模型为 ,该有机物的结构简式为 ,该有机物的结构简式为 | |
| D. | 红斑素、红曲素是常用于糖果、雪糕等食品的着色剂的主要成分,结构分别如下图所示: 则红斑素和红曲素互为同分异构体 |
| 族 周期 | I A | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | O |
| 1 | A | |||||||
| 2 | D | E | G | I | ||||
| 3 | B | C | F | H |
(2)最高价氧化物的水化物碱性最强的是NaOH,酸性最强的是H2SO4,呈两性的是Al(OH)3.
(3)A分别与D、E、F、G、H形成的化合物中,最稳定的HCl.
(4)A和D组成化合物的电子式
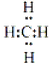 .
.(5)用电子式表示B和H组成化合物的形成过程
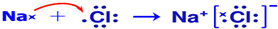
(6)B的最高价氧化物的水化物和C的最高价氧化物的水化物相互反应的离子方程式OH-+Al(OH)3═AlO2-+2H2O.
| A. | 1 | B. | 2 | C. | 3 | D. | 4 |
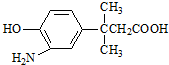 的表述不正确的是( )
的表述不正确的是( )| A. | 该物质能发生缩聚反应 | |
| B. | 该物质的核磁共振氢谱上共有7个峰 | |
| C. | 该物质遇FeCl3溶液显色 | |
| D. | 1 mol该物质最多消耗Na、NaOH、NaHCO3的物质的量之比为2:2:1 |