题目内容
6.有a、b、c、d四种短周期主族元素,它们在周期表中置如图所示,已知四种元素中只有b为金属元素,则下列有关说法中正确的是( )| a | |||
| b | c | d |
| A. | 离子半径:b>c>d>a | |
| B. | bn+与dm-在水溶液中可形成化合物bmdn | |
| C. | 简单氢化物的稳定性:a<c | |
| D. | b和d的最高价氧化物对应的水化物可相互反应 |
分析 a、b、c、d四种短周期主族元素,根据它们在周期表中的相对位置可知a处于第二周期,bcd处于第三周期;四种元素中只有b为金属元素,结构元素周期表结构可知b为Al元素、c为P元素、a为N元素、d为S元素,据此结合元素周期律知识进行解答.
解答 解:a、b、c、d四种短周期主族元素,根据它们在周期表中的相对位置可知a处于第二周期,bcd处于第三周期;四种元素中只有b为金属元素,结构元素周期表结构可知b为Al元素、c为P元素、a为N元素、d为S元素,
A.电子层越多,离子半径越大,电子层相同时,核电荷数越大,离子半径越小,则四种元素的离子半径大小顺序为:c>d>a>b,故A错误;
B.bn+与dm-分别为Al3+与S2-,二者在溶液中发生双水解反应生成氢氧化铝沉淀和硫化氢气体,不会生成Al2S3,故B错误;
C.非金属性越强,对应氢化物越稳定,N的非金属性大于P,则简单氢化物的稳定性:a>c,故C错误;
D.b为Al,其最高价氧化物对应水合物为氢氧化铝,d为S元素,其最高价氧化物对应水合物为硫酸,氢氧化铝与硫酸发生反应生成硫酸铝和水,故D正确;
故选D.
点评 本题考查了原子结构与元素周期律的关系,题目难度中等,推断元素为解答关键,注意掌握原子结构与元素周期律、元素周期表的关系,试题培养了学生的分析能力及灵活应用能力.

练习册系列答案
相关题目
17.中和相同体积、相同pH的Ba(OH)2、NaOH和NH3H2O三种溶液,所用相同浓度的盐酸的体积分别为V1、V2、V3,则三者关系为( )
| A. | V3>V1=V2 | B. | V3=V2>V1 | C. | V3>V2>V1 | D. | V1=V2>V3 |
14.在探究新制饱和氯水成分的实验中,下列根据实验现象得出的结论不正确的是( )
| A. | 氯水的颜色呈浅黄绿色,说明氯水中含有Cl2 | |
| B. | 向氯水中滴加硝酸酸化的AgNO3溶液,产生白色沉淀,说明氯水中含有Cl- | |
| C. | 向氯水中加入NaHCO3粉末;有气泡产生,说明氯水中含有H+ | |
| D. | 氯水中加入氢氧化钠溶液,氯水的黄绿色消失,说明氯水中含有HClO |
20.通常状况下,将1g氢气在氯气中完全燃烧,放出92.4KJ热量,下列所示的热化学方程式正确的是( )
| A. | H2(g)+Cl2(g)=$\frac{1}{2}$HCl(g)△H=92.4KJ/mol | B. | H2(g)+Cl2(g)=$\frac{1}{2}$HCl(g)△H=-92.4KJ/mol | ||
| C. | H2(g)+Cl2(g)=2HCl(g)△H=-184.8KJ/mol | D. | H2(g)+Cl2(g)=2HCl(l)△H=184.8/mol |
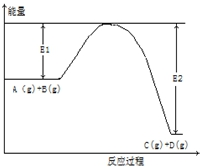 反应A(g)+B(g)?C(g)+2D(g)的能量变化如下图所示,回答下列问题.
反应A(g)+B(g)?C(g)+2D(g)的能量变化如下图所示,回答下列问题.