题目内容
20.某烃的结构简式为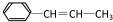 ,它可能具有的性质是( )
,它可能具有的性质是( )| A. | 可以发生加成、取代、氧化反应 | |
| B. | 能使溴水褪色,但不能使酸性高锰酸钾褪色 | |
| C. | 能发生加聚反应,其生成物可用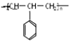 来表示 来表示 | |
| D. | 易溶于水,也易溶于有机溶剂 |
分析 由结构可知, 含有碳碳双键官能团,可发生加成反应、加聚反应,也可发生氧化反应,以此解答该题.
含有碳碳双键官能团,可发生加成反应、加聚反应,也可发生氧化反应,以此解答该题.
解答 解:A.含有碳碳双键,可发生加成、氧化反应,苯环上H及甲基上H均可发生取代反应,故A正确;
B.含碳碳双键,可与溴水发生加成反应而使溴水褪色,可与酸性高锰酸钾发生氧化还原反应而使酸性高锰酸钾溶液褪色,故B错误;
C.其加聚产物为 ,故C错误;
,故C错误;
D.烃类物质都不溶于水,故D错误;
故选A.
点评 本题考查有机物的结构与性质,为高频考点,把握官能团与性质的关系为解答的关键,侧重分析与应用能力的考查,注意加聚产物的结构简式判断,题目难度不大.

练习册系列答案
 99加1领先期末特训卷系列答案
99加1领先期末特训卷系列答案 百强名校期末冲刺100分系列答案
百强名校期末冲刺100分系列答案 好成绩1加1期末冲刺100分系列答案
好成绩1加1期末冲刺100分系列答案 金状元绩优好卷系列答案
金状元绩优好卷系列答案
相关题目
10.下列叙述中,与胶体性质无直接关系的是( )
| A. | 含有少量硫的酒精溶液,加入大量水后形成乳白色液体,用滤纸过滤不能分离出硫 | |
| B. | 原硅酸溶液中加入硫酸铵饱和溶液,结果产生沉淀 | |
| C. | 硫酸铜溶液中加入硫化钠溶液产生黑色沉淀 | |
| D. | 用水稀释牛奶,用一束强光照射,从侧面观察,可以看到一条清晰的光路 |
11.有四组同一族元素所形成的不同物质,在101kPa时测定它们的沸点(℃)如表所示:
下列各项判断正确的是( )
| 第一组 | A-268.8 | B-249.5 | C-185.8 | D-151.7 |
| 第二组 | F2-187.0 | Cl2-33.6 | Br2 58.7 | I2 184.0 |
| 第三组 | HF 19.4 | HCl-84.0 | HBr-67.0 | HI-35.3 |
| 第四组 | H2O 100.0 | H2S-60.2 | H2Se 42.0 | H2Te-1.8 |
| A. | 第一组和第二组物质中一定含有共价键 | |
| B. | 第三组与第四组相比较,化合物的稳定顺序为:HBr>H2Se | |
| C. | 第三组物质溶于水后,溶液的酸性:HF>HCl>HBr>HI | |
| D. | 第四组物质中H2O的沸点最高,是因为H2O分子中化学键键能最强 |
8.为了研究外界条件对过氧化钠分解速率的影响,某同学做了以下实验.
(1)①中过氧化氢分解的化学方程式为2H2O2$\frac{\underline{\;三氯化铁\;}}{\;}$2H2O+O2↑.
(2)实验①的目的是研究温度对H2O2分解速率的影响.
(3)实验②的目的是探究温度和催化剂对反应速率的影响,为达到使用目的,还需进行的后续操作是将两支试管同时放入盛有相同温度热水的烧杯中,或向两支试管中同时滴入2滴1mol/L FeCl3溶液,观察产生气泡的速率.(所用试剂限本实验中提供的).
(4)对于H2O2分解反应,Cu2+也有一定的催化作用.为比较Fe3+和Cu2+对H2O2分解的催化效果,某化学研究小组的同学分别设计了如图甲、乙所示的实验.请回答相关问题:如图所示.同学们分别从定性和定量角度进行了比较.
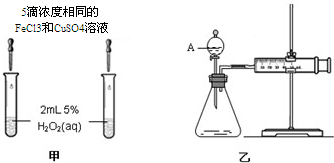
①定性分析:如图甲可通过观察溶液中气泡产生的速率,定性比较得出结论.有同学提出将FeCl3改为Fe2(SO4)3更为合理,其理由是:控制阴离子相同,排除阴离子的干扰.
②定量分析:用图乙所示装置做对照实验,实验时均以生成40mL气体为准,其他可能影响实验的因素均已忽略.实验中需要测量的数据是产生40ml气体所需要的时间.
| 编号 | 操 作 | 实验现象 |
| ① | 分别在试管A、B中加入 5mL 5% H2O2溶液,各滴入1~2 滴1mol/L FeCl3溶液.待试管中均有适量气泡出现时,将试管A放入盛有5℃左右冷水的烧杯中;将试管B放入盛有40℃左右热水的烧杯中. | 试管A中不再产生气泡;试管B中产生的气泡量增大 |
| ② | 另取两支试管分别加入 5mL 5%H2O2溶液和 5mL10%H2O2溶液. | 试管A、B中均未明显见到有气泡产生 |
(2)实验①的目的是研究温度对H2O2分解速率的影响.
(3)实验②的目的是探究温度和催化剂对反应速率的影响,为达到使用目的,还需进行的后续操作是将两支试管同时放入盛有相同温度热水的烧杯中,或向两支试管中同时滴入2滴1mol/L FeCl3溶液,观察产生气泡的速率.(所用试剂限本实验中提供的).
(4)对于H2O2分解反应,Cu2+也有一定的催化作用.为比较Fe3+和Cu2+对H2O2分解的催化效果,某化学研究小组的同学分别设计了如图甲、乙所示的实验.请回答相关问题:如图所示.同学们分别从定性和定量角度进行了比较.

①定性分析:如图甲可通过观察溶液中气泡产生的速率,定性比较得出结论.有同学提出将FeCl3改为Fe2(SO4)3更为合理,其理由是:控制阴离子相同,排除阴离子的干扰.
②定量分析:用图乙所示装置做对照实验,实验时均以生成40mL气体为准,其他可能影响实验的因素均已忽略.实验中需要测量的数据是产生40ml气体所需要的时间.
15.工业上制取CuSO4不是直接用铜和浓硫酸反应,而是将铜和少量银的混合物浸在稀硫酸中,并不断从容器底部吹入细小的空气泡.这样做的优点是( )
①不产生污染大气的SO2 ②提高硫酸的利用率 ③节省能源 ④提高铜的利用率.
①不产生污染大气的SO2 ②提高硫酸的利用率 ③节省能源 ④提高铜的利用率.
| A. | ②③ | B. | ①④ | C. | ①②③ | D. | ①② |
5.设NA为阿伏加德罗常数的值,下列说法正确的是( )
| A. | 7.8g苯中含有C-C单键数目为0.3NA | |
| B. | 标准状况下,2.24L的CHCl3中含有的C-H键数为0.1NA | |
| C. | 1.4g C2H4和C3H8的混合物中含碳原子数为0.1 NA | |
| D. | 13克溶有乙炔的苯乙烯,其所含的电子数目为7 NA |
12.下列每组物质发生变化所克服的粒子间的相互作用属于同种类型的是( )
| A. | 碘和干冰升华 | B. | 氯化钠和冰的熔化 | ||
| C. | 二氧化硅和氧化钠熔化 | D. | 食盐和蔗糖熔化 |
9.下列说法错误的是( )
| A. | ⅦA元素的氢化物中氟化氢的沸点最高 | |
| B. | 第三周期元素形成的简单离子的半径随原子序数的增大依次增大 | |
| C. | I2易溶于CCl4可以用相似相溶原理解释 | |
| D. | CH2=CH2分子中共有5个σ键和1个π键 |
10.通常把拆开1mol某化学键所吸收的能量看成该化学键的键能.已知部分化学键的键能如下:
(1)发射神舟飞船的长征火箭用了肼(N2H4,气态)为燃料,若它在氧气(气态)中燃烧,生成N2(气态)和H2O(液态).1mol肼完全燃烧时放出的热量为577kJ.
(2)肼-空气燃料电池是一种碱性燃料电池,电解质溶液是20%~30%的KOH 溶液.肼-空气燃料电池放电时,正极的电极反应式是O2+2H2O+4e-=4OH-.
(3)已知N60分子中每个N原子均以氮氮键结合三个氮原子,且N60分子结构中每个氮原子均形成8个电子的稳定结构.试推测1个N60的结构含有90个N-N键.
| 化学键 | N-H | N-N | O═O | N≡N | O-H |
| 键能 (kJ•mol-1) | 386 | 167 | 498 | 946 | 460 |
(2)肼-空气燃料电池是一种碱性燃料电池,电解质溶液是20%~30%的KOH 溶液.肼-空气燃料电池放电时,正极的电极反应式是O2+2H2O+4e-=4OH-.
(3)已知N60分子中每个N原子均以氮氮键结合三个氮原子,且N60分子结构中每个氮原子均形成8个电子的稳定结构.试推测1个N60的结构含有90个N-N键.