题目内容
8.请对以下反应进行分析后作出回答:2KMnO4+16HCl→2MnCl2+2KCl+5Cl2↑+8H2O
(1)标写出上述反应中电子转移的方向和数目.
(2)上述反应中发生还原反应的物质是KMnO4,Cl元素被氧化
(3)在标准状况下,当有1.12L Cl2产生时,0.1mol HCl被氧化.
分析 (1)化合价升高,元素失电子,化合价降低,元素得到电子,化合价升高数=化合价降低数=转移电子数;
(2)化合价升高元素失电子被氧化,化合价降低元素所在的反应物是氧化剂发生还原反应;
(3)根据化合价升高元素是HCl中的氯元素,所以HCl是还原剂生成 Cl2,据此计算.
解答 解:(1)反应中,化合价升高元素是氯元素,失电子,化合价降低元素是锰元素,得到电子,化合价升高数=化合价降低数=转移电子数=10,单线桥表示反应中电子转移的方向和数目为: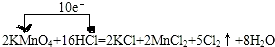 ,
,
故答案为: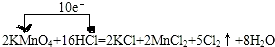 ;
;
(2)反应中,化合价升高元素是氯元素,失电子被氧化,化合价降低元素是锰元素,得到电子被还原,则KMnO4发生还原反应,故答案为:KMnO4;Cl;
(3)反应中,化合价升高元素是HCl中的氯元素,所以HCl是还原剂,所以在标准状况下,当有1.12L Cl2产生时,被氧化的HCl为$\frac{1.12L}{22.4L/mol}$×2=0.1mol,故答案为:0.1.
点评 本题考查学生氧化还原反应的有关知识以及相关计算问题,要求学生要熟记教材知识,灵活应用.

练习册系列答案
 名牌学校分层周周测系列答案
名牌学校分层周周测系列答案 黄冈海淀全程培优测试卷系列答案
黄冈海淀全程培优测试卷系列答案
相关题目
15.图为锌一铜原电池示意图,下列说法错误的是( )
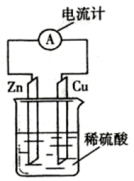

| A. | 电子由铜片通过导线流向锌片 | |
| B. | 锌片为负极,且锌片逐渐浓解 | |
| C. | 铜为正极,铜不易失电了而受到保护 | |
| D. | 该装置能将化学能抟变为电能 |
16.下列关于物质分类的说法正确的是( )
| A. | 稀豆浆、烟水晶、氯化铁溶液都属于胶体 | |
| B. | Na2O、MgO、Mn2O7均属于碱性氧化物 | |
| C. | 氨水、冰醋酸、溴乙烷都属于弱电解质 | |
| D. | 葡萄糖、油脂、氨基酸都不属于有机高分子化合物 |
3.下列过程或现象与盐类水解无关的是( )
| A. | 焊接时可用浓的NH4Cl溶液除去铁锈 | |
| B. | 配制K2S溶液时,常加入少量KOH溶液 | |
| C. | 医院为酸中毒病人输液不用0.9%NH4Cl溶液 | |
| D. | Fe3+与I-在水溶液中不能大量共存 |
13.下列物质中,属于有机高分子材料的是( )
| A. | 不锈钢 | B. | 水泥 | C. | 橡胶 | D. | 陶瓷 |
20.常温下,下列各组离子在指定溶液中一定能大量共存的是( )
| A. | 某澄清透明溶液中:K+、Cu2+、NO3-、Cl- | |
| B. | 含0.1mol•L-1 Fe3+的溶液中:Na+、Mg2+、SO42-、Cl-、SCN- | |
| C. | 含0.1mol•L-1 CO32-的溶液中:OH-、Cl-、NH4+、Na+、H+ | |
| D. | 加入铝粉产生H2的溶液中:Al3+、Na+、SO42-、NO3- |
6.下列溶液中物质的量浓度为1mol•L-1的是( )
| A. | 将250g CuSO4•5H2O溶解在1L水中 | |
| B. | 将22.4L HCl气体溶于水配成1L溶液 | |
| C. | 将1L10mol•L-1的浓盐酸加入9L水中 | |
| D. | 将10g NaOH溶解在少量水中,再加蒸馏水直到溶液体积为250mL |