题目内容
同温下,有甲、乙两瓶醋酸稀溶液,测得甲pH=a,乙pH=a+1,下列推断正确的是( )
| A、物质的量浓度c(甲)是c(乙)的10倍 |
| B、溶液中的c(OH-)甲是乙的10倍 |
| C、由水电离产生的c(H+)乙是甲的10倍 |
| D、与等量的NaOH反应消耗甲、乙两酸的体积V(甲)>10V(乙) |
考点:弱电解质在水溶液中的电离平衡
专题:电离平衡与溶液的pH专题
分析:A.同温下,醋酸浓度越大,醋酸电离程度越小;
B.溶液中的c(OH-)=
;
C.酸溶液中水电离出的c(H+)等于溶液中c(OH-);
D.与等物质的量的NaOH反应消耗酸的体积与酸的浓度成反比.
B.溶液中的c(OH-)=
| Kw |
| c(H+) |
C.酸溶液中水电离出的c(H+)等于溶液中c(OH-);
D.与等物质的量的NaOH反应消耗酸的体积与酸的浓度成反比.
解答:
解:A.同温下,酸的浓度越大其电离程度越小,甲pH=a,乙pH=a+1,所以c(甲)>10c(乙),故A错误;
B.溶液中的c(OH-)=
,同温下,离子积常数相等,氢氧根离子浓度与氢离子浓度成反比,所以甲、乙两种溶液中氢氧根离子浓度之比=10-(a+1) mol/L:10-a mol/L=1:10,故B错误;
C.酸溶液中水电离出的c(H+)等于溶液中c(OH-),所以甲、乙由水电离产生的c(H+)乙是甲的10倍,故C正确;
D.与等物质的量的NaOH反应消耗酸的体积与酸的浓度成反比,c(甲)>10c(乙),所以消耗酸的体积V(甲)<10V(乙),故D错误;
故选C.
B.溶液中的c(OH-)=
| Kw |
| c(H+) |
C.酸溶液中水电离出的c(H+)等于溶液中c(OH-),所以甲、乙由水电离产生的c(H+)乙是甲的10倍,故C正确;
D.与等物质的量的NaOH反应消耗酸的体积与酸的浓度成反比,c(甲)>10c(乙),所以消耗酸的体积V(甲)<10V(乙),故D错误;
故选C.
点评:本题考查弱电解质的电离,知道弱电解质电离程度与其浓度关系是解本题关键,知道酸溶液中水电离出氢离子浓度的计算方法,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
下列电离方程式中正确的是( )
| A、NH3?H2O═NH4++OH- |
| B、H2CO3?CO32-+2H+ |
| C、NaHCO3═Na++H++CO32- |
| D、Al2(SO4)3═2Al3++3SO42- |
| E、Al2(SO4)3═2Al3++3SO42- |
下列措施对增大反应速率明显有效的是( )
| A、Al在氧气中燃烧生成Al2O3,将Al粉改为Al片 |
| B、Fe与稀盐酸反应制取H2时,加入少量醋酸钠粉末 |
| C、Na与水反应时增大水的用量 |
| D、Zn与稀硫酸反应时,适当提高溶液的温度 |
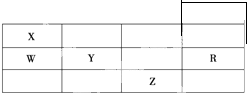 如图为元素周期表前4周期的一部分,下列有关R、W、X、Y、Z 5种元素的叙述中,正确的是( )
如图为元素周期表前4周期的一部分,下列有关R、W、X、Y、Z 5种元素的叙述中,正确的是( )| A、X、Z元素都能够形成双原子分子 |
| B、W、R元素单质分子内的化学键都是非极性键 |
| C、键长X-H<W-H,键能X-H<W-H |
| D、键能W-H>Y-H,键的极性Y-H>W-H |
下列过程或现象与盐类水解无关的是( )
| A、纯碱溶液去油污 |
| B、水中加入明矾可以净化水 |
| C、加热稀醋酸溶液其pH 稍有减小 |
| D、实验室配置FeCl3溶液时,加入少量HCl,以防止溶液浑浊 |
如图是用500mL容量瓶配制0.10mol?L-1 NaOH溶液的过程.错误步骤有( )


| A、1处 | B、2处 | C、3处 | D、4处 |
现有 ①0.1mol/L醋酸溶液;②0.1mol/L盐酸;③pH=1 的醋酸溶液,分别加水稀释,使体积变为原来的10倍,对于稀释前后溶液的有关说法错误的是( )
| A、稀释前,溶液 pH:①>②=③ |
| B、稀释前,溶液中溶质的物质的量浓度:③>①=② |
| C、稀释后,溶液 pH:①>②=③ |
| D、稀释后,溶液中溶质的物质的量浓度:③>①=② |
下列各组物质的最简式相同的是( )
| A、乙酸和乙二酸 |
| B、丁酸和乙酸 |
| C、甲醛和乙酸 |
| D、乙二酸和乙二醇 |