题目内容
13.A、B、C、D、E是原子序数依次增大的短周期主族元素,A是短周期中金属性最强的元素,B是地壳中含量最高的金属元素,C单质的晶体是良好的半导体材料,D的最外层电子数与内层电子数之比为3:5.(1)C的原子结构示意图为
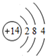 ,D在元素周期表中的位置第3周期第VIA族
,D在元素周期表中的位置第3周期第VIA族(2)A单质在氧气中燃烧生成化合物甲,甲中所含化学键类型为离子键、共价键;A单质在E单质中燃烧生成化合物乙,用电子式表示乙的形成过程
 .
.(3)F是中学化学常见元素,它的一种氧化物为红棕色粉末,B单质与其在高温条件下反应是冶炼F单质的方法之一,该反应的化学方程式为Fe2O3+2Al$\frac{\underline{\;高温\;}}{\;}$2Fe+Al2O3
(4)A、B、D、E的离子半径由大到小的顺序为:S2->Cl->Na+>Al3+;(请用化学用语填写,下同)C、D、E的气态氢化物的稳定性由大到小的顺序为:HCl>H2S>SiH4.
分析 A、B、C、D、E是原子序数依次增大的短周期元素,A是短周期中金属性最强的元素,则A是Na元素,B是地壳中含量最高的金属元素,则B是Al元素,C单质的晶体是良好的半导体材料,则C为Si元素,D的最外层电子数与内层电子数之比为3:5,原子有3个电子层,最外层电子数为6,则D为S元素,故E为Cl元素.
解答 解:A、B、C、D、E是原子序数依次增大的短周期元素,A是短周期中金属性最强的元素,则A是Na元素,B是地壳中含量最高的金属元素,则B是Al元素,C单质的晶体是良好的半导体材料,则C为Si元素,D的最外层电子数与内层电子数之比为3:5,原子有3个电子层,最外层电子数为6,则D为S元素,故E为Cl元素.
(1)C为Si元素,原子结构示意图为: ,D为S元素,在周期表中位置为:第3周期第VIA族,
,D为S元素,在周期表中位置为:第3周期第VIA族,
故答案为: ;第3周期第VIA族;
;第3周期第VIA族;
(2)A为Na,单质在氧气中燃烧生成化合物甲为过氧化钠,过氧化钠中含有离子键、共价键,钠在氯气中燃烧生成NaCl,用电子式表示形成过程为: ,
,
故答案为:离子键、共价键; ;
;
(3)F是中学化学常见元素,它的一种氧化物为红棕色粉末,则F为Fe,红棕色粉末为氧化铁,铝单质与氧化铁在高温条件下反应是冶炼铁的方法之一,该反应的化学方程式为:Fe2O3+2Al$\frac{\underline{\;高温\;}}{\;}$2Fe+Al2O3,
故答案为:Fe2O3+2Al$\frac{\underline{\;高温\;}}{\;}$2Fe+Al2O3;
(4)A、B、D、E形成的简单离子分别为:Na+、Al3+、S2-、Cl-,电子层结构相同,核电荷数越大离子半径越小,电子层越多离子半径越大,故离子半径:S2->Cl->Na+>Al3+,
非金属性Cl>S>Si,元素的非金属性越强,对应的气态氢化物的稳定性越强,即氢化物稳定性:HCl>H2S>SiH4,
故答案为:S2->Cl->Na+>Al3+;HCl>H2S>SiH4.
点评 本题考查结构性质位置关系应用,推断元素是解题关键,掌握微粒半径比较与元素周期律,掌握用电子式表示物质或化学键的形成.

 浙江名校名师金卷系列答案
浙江名校名师金卷系列答案| A. | 1-溴丙烷与NaOH醇溶液共热 | |
| B. | 氯乙烷与NaOH的水溶液共热 | |
| C. | 乙醇与浓H2SO4共热至140℃ | |
| D. | 2,2-二甲基-1-丙醇与浓H2SO4共热至170℃ |
| A. | 2和19 | B. | 6与8 | C. | 8与11 | D. | 9与9 |
| A. | 将氯化钠固体加热到熔融状态产生Na+和Cl- | |
| B. | 将碘单质加热升华 | |
| C. | 将氯化氢气体通入水产生H+和Cl- | |
| D. | 在放电条件下氧气转化为臭氧 |
| A. | 煤的干馏 | |
| B. | 石油裂解 | |
| C. | 煤焦油经分馏得到苯、甲苯、二甲苯等 | |
| D. | 蛋白质的变性 |
 有关柠檬烯的分析正确的是( )
有关柠檬烯的分析正确的是( )| A. | 它的一氯代物有6种 | |
| B. | 它和丁基苯(  )互为同分异构体 )互为同分异构体 | |
| C. | 它的分子中所有的碳原子一定在同一平面上 | |
| D. | 一定条件下,它分别可以发生加成、取代、氧化、还原等反应 |